|
||||||||||||||||||||||||
Приказ Федеральной службы по надзору в сфере защиты прав
потребителей и благополучия человека от 12 октября 2007 г. N 280
"Об утверждении и
внедрении методических рекомендаций "Оценка безопасности
наноматериалов"
В соответствии с решением постоянно действующего совещания Федеральной службы по надзору в сфере защиты прав потребителей от 03.07.2007 N 9 "О надзоре за производством, использующим нанотехнологии и оборотом продукции содержащей наноматериалы" приказываю:
1. Утвердить методические рекомендации "Оценка безопасности наноматериалов" (Приложение).
2. Руководителям Управлений Роспотребнадзора по субъектам Российской Федерации, главным врачам ФГУЗ "Центр гигиены и эпидемиологии в субъектах Российской Федерации":
2.1. Внедрить методические рекомендации в работу;
2.2. Использовать методические рекомендации при проведении санитарно- эпидемиологической экспертизы и государственной регистрации продукции, полученной с использованием нанотехнологии или содержащей наноматериалы
3. Контроль за исполнением приказа возложить на заместителя руководителя Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека Л.П. Гульченко.
Руководитель Г.Г. Онищенко
Приложение
Оценка безопасности наноматериалов
Методические рекомендации
(утв. приказом Федеральной службы по надзору в сфере защиты прав потребителей и
благополучия человека от 12 октября 2007 г. N 280)
Содержание
Введены в действие с 1 декабря 2007 г.
Оценка безопасности наноматериалов: Методические рекомендации, М,.: ФГУЗ "Федеральный центр гигиены и эпидемиологии" Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека, 2007.
Разработаны:
Федеральной службой по надзору в сфере защиты прав потребителей и благополучия человека (Г.Г. Онищенко, Б.Г. Бокитько),
Научно-исследовательским институтом питания РАМН (В.А. Тутельян, И.В. Аксенов, В.В. Бессонов, М.М. Гаппаров, И.В. Гмошинский, С.А. Хотимченко, С.А. Шевелева),
Научно-исследовательским институтом микробиологии и эпидемиологии им. Почетного академика Н.Ф. Гамалеи РАМН (А.Л. Гинцбург, Б.С. Народицкий),
Научно-исследовательским институтом биомедицинской химии им. В.Н. Ореховича РАМН (А.И. Арчаков),
Научно-исследовательским институтом экологии человека и гигиены окружающей среды им. А.Н. Сысина РАМН (Ю.А. Рахманин),
Научно-исследовательским институтом медицины труда РАМН (Н.Ф. Измеров),
Государственным научным центром Российской Федерации - Институт медико-биологических проблем РАН (А.И. Григорьев),
Московским государственным университетом Минобрнауки России (М.П. Кирпичников, К.В. Шайтан),
Центральным Научно-исследовательским институтом эпидемиологии Роспотребнадзора (В.И. Покровский),
Федеральным научным центром гигиены им. Ф.Ф. Эрисмана Роспотребнадзора (А.И. Потапов).
Утверждены Руководителем Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека, Главным государственным санитарным врачом Российской Федерации Г.Г. Онищенко 12 октября 2007 г.
Введены в действие с 1 декабря 2007 г.
1. Введение.
В настоящее время все возрастающее внимание во всем мире уделяется перспективам развития нанотехнологий, то есть технологий направленного получения и использования веществ и материалов в диапазоне размеров до 100 нанометров. Особенности поведения вещества в виде частиц таких размеров, свойства которых во многом определяются законами квантовой физики, открывают широкие перспективы в целенаправленном получении материалов с новыми свойствами, такими как уникальная механическая прочность, особые спектральные, электрические, магнитные, химические, биологические характеристики. Такие материалы могут найти и уже находят применение в микроэлектронике, энергетике, строительстве, химической промышленности, научных исследованиях. Уникальные свойства наноматериалов и их биологическая активность могут быть использованы, в частности, для адресной доставки лекарственных препаратов, для борьбы с онкологическими заболеваниями и опасными инфекциями, для целей генной и молекулярной инженерии, для улучшения качества окружающей среды, в парфюмерно-косметической и пищевой промышленности и многих иных приложениях. Использование нанотехнологий и наноматериалов бесспорно является одним из самых перспективных направлений науки и техники в XXI веке. Учитывая, что в перспективе ожидается тесный контакт человека и других биологических объектов с наноматериалами, изучение вопросов потенциальных рисков их использования представляется первостепенной задачей.
В настоящее время основными областями применения наночастиц в технике, определяемыми их уникальными свойствами, отличными от свойств веществ в обычной (макродисперсной) форме, становятся создание высокопрочных, в том числе композитных, конструкционных материалов, микроэлектроника и оптика (микросхемы, компьютеры, оптические затворы), энергетика (аккумуляторы, топливные элементы, высокотемпературная сверхпроводимость), химическая технология (катализ), охрана окружающей среды (наночипы и наносенсоры). В медицине наноматериалы находят применение для целей транспорта лекарственных средств, в шовных и перевязочных материалах, для создания биосовместимых имплантантов и др. В парфюмерно-косметической промышленности наночастицы используются как составная часть солнцезащитных кремов; в сельском хозяйстве - для более эффективной доставки пестицидов и удобрений, для нанокапсулирования вакцин; предполагается использование наночастиц для доставки ДНК в растения для целей генной инженерии. В пищевой промышленности наноматериалы находят применение в фильтрах для очистки воды, при получении более легких, прочных, более термически устойчивых и обладающих антимикробным действием упаковочных материалов, при обогащении пищевых продуктов микронутриентами. Использование наночипов предполагается для идентификации условий и сроков хранения пищевой продукции и обнаружения патогенных микроорганизмов.
Наночастицы и наноматериалы обладают комплексом физических, химических свойств и биологическим действием, которые часто радикально отличаются от свойств этого же вещества в форме сплошных фаз или макроскопических дисперсий. Эта специфика наноматериалов определяется известными законами квантовой физики. В наноразмерном состоянии можно выделить ряд физико-химических особенностей поведения веществ.
1. Увеличение химического потенциала веществ на межфазной границе высокой кривизны. Для макрочастиц (размерами порядка микрона и более) данный эффект незначителен (не более долей процента). Большая кривизна поверхности наночастиц и изменение топологии связи атомов на поверхности приводит к изменению их химических потенциалов. Вследствие этого существенно изменяется растворимость, реакционная и каталитическая способность наночастиц и их компонентов.
2. Большая удельная поверхность наноматериалов. Очень высокая удельная поверхность (в расчете на единицу массы) наноматериалов увеличивает их адсорбционную емкость, химическую реакционную способность и каталитические свойства. Это может приводить, в частности, к увеличению продукции свободных радикалов и активных форм кислорода и далее к повреждению биологических структур (липиды, белки, нуклеиновые кислоты, в частности, ДНК).
3. Небольшие размеры и разнообразие форм наночастиц. Наночастицы, вследствие своих небольших размеров, могут связываться с нуклеиновыми кислотами (вызывая, например, образование аддуктов ДНК), белками, встраиваться в мембраны, проникать в клеточные органеллы и, тем самым, изменять функции биоструктур. Следует обратить внимание на то, что наночастицы могут не вызывать иммунный ответ. Процессы переноса наночастиц в окружающей среде с воздушными и водными потоками, их накопление в почве, донных отложениях могут также значительно отличаться от поведения частиц веществ более крупного размера.
4. Высокая адсорбционная активность. Из-за своей высокоразвитой поверхности наночастицы обладают свойствами высокоэффективных адсорбентов, то есть способны поглощать на единицу своей массы во много раз больше адсорбируемых веществ, чем макроскопические дисперсии. Возможна, в частности, адсорбция на наночастицах различных контаминантов и облегчение их транспорта внутрь клетки, что резко увеличивает токсичность последних. Многие наноматериалы обладают гидрофобными свойствами или являются электрически заряженными, что усиливает как процессы адсорбции на них различных токсикантов, так и их способность проникать через барьеры организма.
5. Высокая способность к аккумуляции. Возможно, что из-за малого размера наночастицы не распознаются защитными системами организма, не подвергаются биотрансформации и не выводятся из организма. Это ведет к накоплению наноматериалов в растительных, животных организмах, а также микроорганизмах, передаче по пищевой цепи, что, тем самым, увеличивает их поступление в организм человека.
Таким образом, совокупность изложенных факторов свидетельствует о том, что наноматериалы могут обладать совершенно иными физико-химическими свойствами и биологическим (в том числе токсическим) действием, чем вещества в обычном физико-химическом состоянии, а поэтому они должны во всех случаях быть отнесены к новым видам материалов и продукции, характеристика потенциального риска которых для здоровья человека и состояния среды обитания во всех случаях является обязательной.
2. Область применения.
Методические рекомендации устанавливают требования к проведению исследований безопасности наноматериалов и продукции, полученной с использованием нанотехнологии.
Методические рекомендации предназначены для учреждений санитарно-эпидемиологической службы Российской Федерации, осуществляющих государственный санитарно-эпидемиологический надзор, а также для других учреждений, аккредитованных на проведение работ в этой области.
Требования, изложенные в настоящих методических рекомендациях в отношении продукции, полученной с использованием нанотехнологии или содержащей наноматериалы, применяются при государственной санитарно-эпидемиологической экспертизе и государственной регистрации на этапах: постановки на производство; ввозе в страну; реализации.
Методические рекомендации разработаны с целью обеспечения единого, научно-обоснованного подхода к оценке безопасности наноматериалов на этапах разработки, экспертизы и государственной регистрации этой продукции.
Производитель новой продукции, полученной методами нанотехнологии или содержащей наноматериалы, предназначенной для реализации на территории Российской Федерации, должен выпускать ее маркированной в соответствии с установленным порядком.
3. Нормативные ссылки.
1. Основы государственной политики в области обеспечения химической и биологической безопасности Российской Федерации на период до 2010 года и дальнейшую перспективу (утверждено Президентом Российской Федерации 4 декабря 2003 года N ПР-2194).
2. Федеральный Закон N 52-ФЗ "О санитарно-эпидемиологическом благополучии населения".
3. Федеральный Закон N 29-ФЗ "О качестве и безопасности пищевых продуктов".
4. Федеральный Закон N 139-ФЗ от 19.07.2007 года "О Российской корпорации нанотехнологий".
5. Постановление Правительства Российской Федерации N 988 от 21.12.2000 "О государственной регистрации новых пищевых продуктов, материалов и изделий".
6. Постановление Главного государственного санитарного врача Российской Федерации N 54 от 23.07.2007 г. "О надзоре за продукцией, полученной с использованием нанотехнологий и содержащей наноматериалы".
4. Термины и определения.
Наночастицы - высокодисперсные частицы размером менее 100 нм хотя бы в одном измерении с заданной структурой и свойствами.
Наноматериалы - материалы и продукция, существенным компонентом, определяющим их свойства и назначение, являются входящие в их состав наночастицы.
Нанотехнологии - совокупность методов направленного получения и использования наночастиц.
Безопасность наноматериалов - отсутствие у наноматериалов опасности для здоровья людей нынешнего и будущего поколений.
Документация - записи в любой форме, которые описывают методы проведения и/или результаты исследования наноматериалов, а также факторы, влияющие на проведение исследования, и действия, совершаемые при проведении исследования.
Материалы исследования наноматериалов - комплект документов изучения наноматериалов, включающий отчеты по химическим, физическим, биологическим, микробиологическим, токсикологическим и другим экспериментальным научным исследованиям или литературные данные относительно состава, показателей качества и методов контроля качества, свойств, специфической активности и безопасности наноматериалов, включая протоколы проведенных испытаний.
Отчет - представленные в письменной форме результаты исследования наноматериалов, включающие описание инструментальных, биологических и статистических методов, данные, полученные в ходе исследования, и выводы.
Первичные данные исследования - документы, отражающие наблюдения и манипуляции, проводимые во время исследования (записи в рабочих листах, лабораторных журналах, фотографии и фильмы, распечатки с автоматизированных приборов, дискеты, записи параметров окружающей среды в комнатах содержания животных, сертификаты на животных, текущая документация состояния здоровья животных, записи об эксплуатации и техническом обслуживании оборудования, расчетные процедуры).
Протокол исследования - документ, который описывает задачи, методологию, процедуры, методы статистической обработки данных и организацию исследования.
Руководитель исследования - лицо, ответственное за проведение исследования.
Стандартные операционные процедуры - документы, в которых детально изложено выполнение определенных лабораторных процедур, которые, как правило, не детализированы в протоколах исследований и методических руководствах (далее - СОП).
Тест-система - биологическая, химическая, физическая и информационная системы или их комбинации, используемые при проведении исследований.
5. Организация исследований безопасности наноматериалов.
5.1. Общие положения.
Проведения настоящих исследований определяются правилами надлежащей лабораторной практики.
Исследования безопасности наноматериалов включают в себя химические, физические, биологические, микробиологические, токсикологические и другие экспериментальные исследования с целью получения научными методами оценок и доказательств безопасности для здоровья человека.
Проведение исследований осуществляется организациями любой формы собственности, имеющие# необходимую материально-техническую базу, квалифицированных специалистов, проводящие# исследования безопасности наноматериалов в соответствии с настоящими рекомендациями и аккредитованными на проведение таких исследований в установленном порядке.
Порядок проведения санитарно-эпидемиологических экспертиз, обследований, исследований, испытаний, токсикологических, гигиенических и иных видов оценок наноматериалов и продукции, полученной с их использованием, определяется согласно Приказу Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека N 224 от 19.07.2007 г. "О санитарно-эпидемиологических экспертизах, обследованиях, исследованиях, испытаниях и токсикологических, гигиенических и иных видах оценок".
Федеральная служба по надзору в сфере защиты прав потребителей и благополучия человека вправе отказать в проведении исследований безопасности наноматериалов в случаях представления заявителем неполного комплекта документов, необходимого для принятия решения о проведении исследований; недостоверной информации; несоответствия основным требованиям, предъявляемым к организациям, проводящим исследования (состояние материально-технической базы, квалификация сотрудников, оснащение оборудованием и др.), указанным в соответствующих разделах настоящих указаний.
Федеральная служба по надзору в сфере защиты прав потребителей и благополучия человека осуществляет периодические проверки деятельности организаций, получивших право на проведение исследований наноматериалов, которые включают оценку соответствия проведения исследования требованиям действующего законодательства, сравнение исходных данных и заключительного отчета, анализ результатов исследования, рассмотрение материалов архива.
Федеральная служба по надзору в сфере защиты прав потребителей и благополучия человека составляет, публикует и поддерживает в актуальном состоянии перечень организаций, осуществляющих проведение исследований наноматериалов в соответствии с настоящими рекомендациями.
5.2. Принципы проведения исследований наноматериалов.
Целью комплекса физических, химических, биологических, микробиологических, токсикологических и иных исследований наноматериалов является получение научными методами оценок и доказательств безопасности наноматериалов.
Исследования наноматериалов проводятся по утвержденному плану с ведением протокола и составлением отчета, в который заносятся результаты исследований.
Исследования наноматериалов на животных проводятся в соответствии с международными правилами. Контроль за соблюдением правовых и этических норм использования животных при проведении исследований наноматериалов осуществляется Федеральной службой по надзору в сфере защиты прав потребителей и благополучия человека.
Сбор, обработка и хранение информации, полученной в ходе исследования наноматериалов, должны обеспечивать точное и обоснованное представление о безопасности наноматериалов для здоровья человека и объективность данных, полученных в ходе исследования.
Хранение и использование исследуемых наноматериалов осуществляется в соответствии с утвержденным протоколом исследования.
Организация, проводящая исследования наноматериалов, должна быть укомплектована персоналом, имеющим необходимое образование, подготовку, квалификацию, опыт работы и аккредитована на проведение исследований в установленном порядке.
Руководитель организации согласовывает протокол, назначает руководителя исследования и ответственных лиц из числа сотрудников, не участвующих в исследовании, для осуществления независимого контроля качества проведения исследования, обеспечивает своевременное повышение квалификации и подготовку персонала.
Персонал, принимающий участие в проведении исследования, знакомится с протоколом, информацией об исследуемом наноматериале, а также с функциями и обязанностями лиц, участвующих в исследовании.
Руководитель исследования организует, осуществляет и контролирует: проведение исследования; выполнение протокола исследования и поправок к нему, стандартные операционные процедуры; обеспечение доступа персонала к материалам исследования; соблюдение правил проведения качественных исследований; конфиденциальность полученных результатов; ответственных исполнителей.
Ответственные исполнители обеспечивают подготовку и проведение ключевых этапов исследования, включая обучение персонала; контроль соблюдения стандартных методов и процедур, сбор и документирование полученных данных; ведение учета непредвиденных обстоятельств и принятие мер по их устранению; представление результатов исследования в виде отчета.
5.3. Система обеспечения качества исследований безопасности наноматериалов.
Качество проведения исследований обеспечивается контролем со стороны руководителя исследования и независимой и систематической проверкой документации и деятельности, относящейся к исследованию, проводимой с целью подтверждения факта осуществления указанной деятельности и оценки соответствия процедур сбора, обработки и представления данных требованиям действующего законодательства, настоящих рекомендаций, протоколу исследования, стандартным процедурам.
Контроль за качеством проведения исследований наноматериалов включает в себя оформление перечня исследований, проводимых в организации, с указанием для каждого исследования руководителя и заказчика, названия исследуемого наноматериала, описания тест-системы, даты начала и состояния каждого исследования на текущий момент времени; оценку протоколов и методов исследования на соответствие правилам лабораторной практики; мониторинг текущих исследований; отчет о проведенных проверках и рекомендации по устранению недостатков.
Для осуществления контроля качества руководство организации, проводящей исследования безопасности наноматериалов, должно назначить в соответствии с правилами лабораторной практики ответственных лиц за мониторинг исследования из числа сотрудников, не участвующих в исследовании.
По результатам мониторинга оформляется заключение о ходе проведения исследования, которое доводится до сведения руководства организации и руководителя исследования, а в случае выявления недостатков и нарушений представляются рекомендации по их устранению.
5.4. Помещения.
Помещения, предназначенные для проведения исследований наноматериалов, должны располагаться, проектироваться, приспосабливаться и эксплуатироваться таким образом, чтобы обеспечить качественное выполнение проводимых исследований. Для исследований на животных обязательно наличие вивария.
Помещения для лабораторных животных должны:
- обеспечивать изоляцию (карантин) поступающих животных, больных животных и животных, подозреваемых в носительстве инфекций;
- позволять раздельное содержание различных видов животных и животных одного вида, являющихся объектом исследования различных наноматериалов;
- соответствовать требованиям санитарно-эпидемиологического и ветеринарного законодательства.
Корма, оборудование и инвентарь для ухода за животными необходимо хранить в помещениях, изолированных от мест содержания животных. Помещения для проведения исследований наноматериалов, в том числе для работы с опасными для здоровья и жизни человека объектами исследования, должны соответствовать установленным санитарно-гигиеническим правилам.
5.5. Оборудование.
Организации, проводящие исследования безопасности наноматериалов, должны быть оснащены необходимым оборудованием, прошедшим метрологический контроль и калибровку в установленном порядке.
Эксплуатация оборудования проводится в соответствии с техническим паспортом и инструкцией по применению. Результаты проведения профилактических осмотров оборудования и текущего ремонта фиксируются в специальном журнале, доступном в любое время сотрудникам, эксплуатирующим оборудование или обеспечивающим его обслуживание, и содержащем следующие сведения: наименование прибора, производителя, страны происхождения, модель прибора, серийный (заводской) номер, дата получения и постановки на учет в лаборатории, дата запуска в эксплуатацию, инвентарный номер, место расположения прибора, сотрудник, ответственный за использование прибора, сотрудник (подразделение, организация), ответственный за техническое обслуживание прибора, детальные записи о плановом обслуживании оборудования, датированные и заверенные подписью ответственного лица, детальные записи о любых повреждениях, отказах, ремонте прибора, датированные и заверенные подписью сотрудника (лица), ответственного за техническое состояние прибора, детальные записи о калибровке прибора, датированные и заверенные подписью лица, ответственного за обслуживание прибора.
5.6. Требования к применяемым тест-системам.
Вид, размер и характеристики тест-систем должны соответствовать категориям исследований безопасности наноматериалов. Условия проведения исследований на тест-системах должны исключать воздействие внешних факторов, способных повлиять на качество получаемых данных.
Исследования проводятся на здоровых животных. Все процедуры, связанные с уходом за животными (кормление, поение, смена подстилки, пересаживание, мытье клеток, уборка помещений, в которых содержатся животные), описываются в стандартных операционных процедурах.
Вновь прибывших животных изолируют для оценки состояния их здоровья. Источники поступления, условия и дата поступления должны быть документально оформлены. В случае ухудшения состояния здоровья животных и их гибели, не связанных с проведением исследования, указанных животных необходимо изолировать от основной группы и подвергнуть, при необходимости, лечению, если это допускается протоколом исследования, или гуманному умерщвлению. Диагноз, лечение и его результаты должны быть документированы.
Для обеспечения индивидуального наблюдения в процессе выполнения исследования животные должны быть идентифицированы. Способ идентификации животного документируется. Все клетки, вольеры, контейнеры, предназначенные для содержания животных, также подлежат маркировке. Животные, предназначенные для исследования различных наноматериалов, пространственно изолируются друг от друга.
Корма и вода для животных должны обеспечивать пищевые потребности в соответствии с протоколом исследования, быть свободными от патогенных микроорганизмов и вредных примесей и не должны влиять на результаты исследования.
Места содержания животных и производственные помещения подвергаются периодической санитарной обработке, не оказывающей влияния на результаты исследования.
5.7. Исследуемые и стандартные образцы.
Физическое или юридическое лицо, независимо от форм собственности (заказчик), предоставляет в организацию, проводящую исследования наноматериалов: собственно исследуемый наноматериал и (или) содержащую его продукцию; необходимую документацию (с указанием температурного режима, условий и сроков хранения исследуемого материала, данные по стабильности, информацию о мерах по обеспечению безопасности работы с исследуемым материалом, растворители и процедуры растворения или диспергирования), а также, если необходимо, устройства для введения материала животным.
Исследуемый наноматериал должен иметь упаковку для защиты при транспортировке от загрязнения или порчи.
В составе документации, представляемой вместе с исследуемым образцом (образцами), обязательно должны присутствовать:
- декларация изготовителя о наличии в составе продукции компонентов, полученных с помощью нанотехнологий,
- данные по химическому составу и свойствам наноматериалов, входящим в состав продукции (название наноматериалов, их химическую формулу, состав, размер, геометрическую форму, объем, массу, площадь поверхности, заряд, магнитные свойства частиц, их поверхностные характеристики, способность к образованию ассоциатов (агрегатов).
Все данные должны быть представлены на русском языке в соответствии с систематической номенклатурой IUPAC.
Изготовитель представляет метод обнаружения, идентификации и количественного определения наноматериалов, позволяющий отличить их от аналогичных веществ в традиционной форме.
При декларировании биологических свойств наноматериалов (повышение всасывания, усвояемости и биодоступности, улучшение стабильности продукта при хранении, антиоксидантные эффекты, антимикробное действие и т.д.) изготовитель представляет протоколы соответствующих экспериментальных исследований и клинических наблюдений.
Организация, проводящая исследование наноматериалов, должна:
Иметь утвержденный порядок приема и учета поступления наноматериалов.
Проводить учет наноматериалов при поступлении, расходовании, возврате заказчику или их утилизации.
Принимать меры по обеспечению идентификации исследуемых и стандартных веществ (этикетка с указанием названия, химической формулы, номера серии, даты выпуска, условий хранения и сроков годности) и их стабильности на протяжении всего исследования.
Хранить исследуемый образец отдельно от веществ, реактивов, препаратов сравнения в соответствии с рекомендациями заказчика, с соблюдением условий хранения, указанных производителем, в течение всего срока годности.
5.8. Стандартные операционные процедуры (СОП).
Стандартные операционные процедуры разрабатываются на все производственные операции, включая: поступление, идентификацию, маркировку, обработку, отбор проб, использование и хранение исследуемых и стандартных веществ; обслуживание и калибровку измерительных приборов и оборудования для контроля окружающей среды; приготовление реактивов, питательных сред, кормов; ведение записей, отчетов и их хранение; обслуживание помещений, в которых содержатся тест-системы; прием, транспортировку, размещение, описание, идентификацию и уход за тест-системами; обращение с тест-системами; обезвреживание или утилизация тест-системы; осуществление программы по обеспечению качества.
Соблюдение стандартных операционных процедур осуществляется в целях обеспечения качества, достоверности и воспроизводимости результатов исследования.
Отклонения от СОП должны быть документально оформлены и согласованы с руководителем исследования. Стандартные операционные процедуры подлежат своевременному пересмотру.
5.9. Планирование и проведение исследований.
Исследование безопасности наноматериалов должно проводиться в соответствии с протоколом, отражающим цели работы и методы, используемые для достижения этих целей. Протокол исследования должен быть утвержден руководителем организации, проводящей исследования.
Протокол включает в себя:
- цель исследования;
- задача исследования;
- имеющиеся сведения об исследуемом наноматериале (физические, химические, биологические, токсикологические свойства);
- сведения о контрольном материале традиционной степени дисперсности (физические, химические, биологические, токсикологические свойства);
- используемые методы исследования;
- описание используемой в исследовании тест-системы;
- способы и пути введения исследуемого и контрольного образца;
- схема исследования, обоснование избранной схемы исследования;
- этические и правовые нормы лабораторного исследования;
- критерии оценки эффективности и безопасности исследуемого наноматериала;
- статистическая обработка результатов исследования;
- порядок составления отчета;
- список литературы.
Вносимые изменения в протокол исследования утверждаются руководителем исследования, а отклонения от протокола (незапланированные события, непредвиденные обстоятельства, упущения) записываются, пронумеровываются, подписываются, датируются в приложении с указанием причин.
5.10. Записи результатов исследования.
В организации, проводящей исследования безопасности наноматериалов, должны сохраняться все исходные данные, результаты измерений и наблюдений, вычислений и преобразования данных, записи о калибровке оборудования, отчеты (в том числе промежуточные), а также другие материалы и документы, имеющие непосредственное отношение к данному исследованию.
Данные, образцы, навески и т.д. должны иметь индивидуальный шифр, позволяющий однозначно идентифицировать исследование, использовавшийся тест, метод, вид исследования, биологическую систему и ссылку на сотрудников лаборатории, принимавших участие в получении данных или образцов, в подготовке или проведении исследования.
Первичные данные, полученные в ходе исследования, должны быть немедленно зарегистрированы, подписаны и датированы, не допускается их уничтожение, подмена или перезапись. Данные на электронных носителях обязательно дублируются в бумажном варианте.
Исправления первичных данных оформляются в виде дополнений, которые подписываются и датируются ответственными исполнителями, с указанием причин ошибок.
Материалы исследования должны позволять восстановить ход исследования. После проведения исследования материалы передаются в архив. Условия архива должны обеспечивать безопасное и конфиденциальное хранение всех материалов исследования.
5.11. Требования к отчету о проведенных исследованиях.
По окончании исследований оформляется отчет, в котором должны быть представлены:
- название, адрес организации, даты начала и завершения исследований, цель и задачи исследования.
- описание исследуемого наноматериала, включая имеющиеся сведения о физических, химических, биологических, токсикологических свойствах,
- вид исследования, характеристика и обоснование тест-системы, отобранной для проведения исследований.
В случае проведения экспериментальных исследований на животных необходимо указать:
- вид, возраст, количество животных в каждой группе, пол, показатели массы тела, источник питания,
- режим дозирования, форма, кратность и путь введения исследуемого наноматериала,
- схема проведения исследования наноматериала,
- описание методов статистической обработки результатов, результаты исследования, представленные в виде обобщающих таблиц (графиков) с соответствующей статистической обработкой, и комментариев к ним, обсуждение результатов, выводы, список использованной литературы.
Отчет о результатах проведения исследований составляется руководителем исследований, подписывается руководителем организации и скрепляется печатью организации.
Дополнения к отчету должны быть оформлены в виде приложений, содержащих ссылку на соответствующий раздел отчета (параграф, рисунок, таблицу и т.д.) и подписанных руководителем организации.
5.12. Меры конфиденциальности.
Сотрудники, принимающие участие в проведении исследования наноматериалов, обязаны соблюдать конфиденциальность в отношении любых данных, полученных в ходе исследования, в соответствии с законодательством Российской Федерации.
Организация, проводящая исследования наноматериалов, должна обеспечить конфиденциальность результатов исследований в рамках принятых ею обязательств и в соответствии с законодательством Российской Федерации.
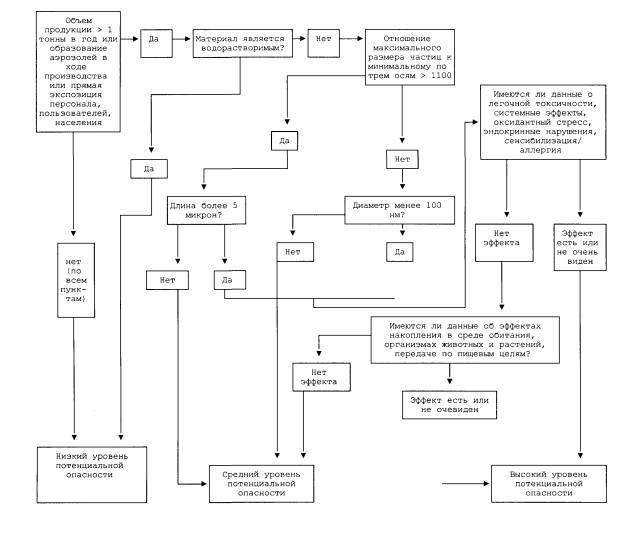
6. Алгоритм определения уровня потенциальной опасности наноматериалов для здоровья человека.
Перед проведением всего комплекса токсиколого-гигиенических исследований каждого отдельного наноматериала и содержащей его продукции на основании документации заявителя и собственных данных организации, проводящей исследование, должна быть выполнена предварительная оценка уровня их потенциальной опасности для здоровья человека. При этом выделяются три уровня потенциальной опасности.
1. Низкий уровень потенциальной опасности (низкий приоритет). Соответствующий наноматериал оценивается по имеющимся показателям для составляющих его компонентов в традиционной форме (макродисперсной или в виде сплошных фаз). Исследований по специфическому биологическому действию компонентов в виде наночастиц не требуется.
2. Средний уровень потенциальной опасности (средний приоритет). Осуществляется общетоксикологическая оценка материала и, при необходимости, проводятся некоторые виды специальных исследований.
3. Высокий уровень потенциальной опасности (высокий приоритет). Проводится полный комплекс исследований по проникновению наноматериалов через биологические мембраны и барьеры организма, распределению по органам и тканям, накоплению в жировой ткани, выведению из организма, общетоксикологическая оценка (острая, подострая и хроническая токсичность), комплекс специальных исследований, включающий тестирование генотоксичности, мутагенности, тератогенности, влияния наноматериалов на геномный (экспрессия генов), протеомный и метаболомный профиль организма, иммунотоксичности, органотоксичности, проницаемости барьера желудочно-кишечного тракта, аллергенности.
Алгоритм оценки уровня потенциальной опасности основывается на фундаментальных характеристиках тестируемого материала, декларируемых заявителем и (или) известных из данных литературы, и представляет собой следующее.
П.1. а) Является ли объем производства наноматериала большим, чем 1 т/год, или б) образуются ли аэрозоли в ходе производства, или в) возможна ли прямая экспозиция материалом персонала производства, потребителей продукции, населения?
- Если нет (по всем пунктам), то: низкий уровень потенциальной опасности.
- Если да (хотя бы по одному из пунктов), то - переход к П.2.
П.2. Является ли материал водорастворимым?
- Если нет - переход к П.3.
- Если да - то: низкий уровень потенциальной опасности.
П.3. Является ли отношение максимального размера частицы к минимальному по трем пространственным осям большим 1:100?
- Если нет - переход к П.5.
- Если да - переход к П.4
П.4. Превосходит ли максимальная размерность (длина) частиц 5 микрон?
- Если нет - средний уровень потенциальной опасности
- Если да - переход к П.6
П.5. Превосходит ли минимальная размерность (диаметр) частиц 100 нм?
- Если нет - переход к П.6
- Если да - средний уровень потенциальной опасности.
П.6. Каковы данные о токсичности, системном воздействии на организм, способности вызывать оксидантный стресс, эндокринные нарушения, аллергизацию у данного вида наноматериалов?
- Если имеются данные об отсутствии всех указанных эффектов - переход к П.7.
- Если имеются данные о наличии хотя бы одного эффекта или данные по всем эффектам отсутствуют - высокой уровень потенциальной опасности.
П.7. Имеются ли данные о возможности накопления наноматерала в среде обитания и организмах животных и растений, или о возможности дальнего переноса и передачи по пищевым цепям?
- Если имеются данные об отсутствии эффекта - средний уровень потенциальной опасности
- Если имеются данные о наличии эффекта или данные отсутствуют - высокий уровень потенциальной опасности.
Схематически данный алгоритм приведен на рисунке.
Рисунок. Схема алгоритма определения уровня потенциальной опасности наноматериала для здоровья человека
7. Методы изучения основных физических, химических и молекулярно-биологических свойств наноматериалов.
Перед проведением медико-биологической оценки наноматериалов и содержащей их продукции должны быть определены физические и химические показатели, характеризующие функциональные свойства тестируемых наноматериалов. Данные предоставляются заявителем в виде заверенных протоколов исследований или могут быть получены организацией, проводящей экспертную оценку. Перечень основных показателей и основные методы, рекомендуемые при их характеристике, приведены в таблице.
|
Показатель |
Рекомендуемый метод определения |
|
Химический состав частиц наноматериала |
Элементный анализ. |
|
- атомно-эмиссионная спектрометрия с индуктивно связанной плазмой |
|
|
- атомно-абсорбционная спектрофотометрия |
|
|
- инверсионная вольтамперометрия |
|
|
Фазовый состав частиц наноматериала |
- масс-спектрометрия высокого разрешения с лазерной ионизацией и десорбцией на матрице (MALDI) |
|
- рентгеноэмиссионная спектрометрия. |
|
|
- рентгеновская фотоэлектронная спектроскопия (ESCA). |
|
|
- гамма-резонансная Мессбауэровская спектрометрия |
|
|
- спектроскопия электронного парамагнитного резонанса |
|
|
- спектроскопия ядерного магнитного резонанса |
|
|
Распределение частиц наноматериалов по размерам |
- лазерная корреляционная спектрометрия |
|
Форма наночастиц |
- сканирующая туннельная микроскопия |
|
|
- атомно-силовая микроскопия |
|
|
- просвечивающая и сканирующая растровая электронная микроскопия. |
|
Определение удельной поверхности |
- метод BET (изотермы адсорбции инертных газов) и гелиевая пикнометрия |
|
Оценка взаимодействия с биологическими макромолекулами (нуклеиновыми кислотами, белками, липидами и биологическим мембранами), возможность проникновения через биологические барьеры |
- атомно-силовая микроскопия |
|
- сканирующая и просвечивающая электронная микроскопия, |
|
|
- светооптическая флуоресцентная микроскопия, |
|
|
- светооптическая конфокальная микроскопия, |
|
|
- спектрометрия деполяризации флуоресценции, |
|
|
- спектрометрия кругового дихроизма, |
|
|
- спектрофлуориметрия, |
|
|
- ЯМР- и ЭПР-спектрометрия, |
|
|
- масс-спектрометрия, |
|
|
- метод радиоактивных индикаторов, |
|
|
- аналитическое ультрацентрифугирование, |
|
|
- жидкостная хроматография высокого разрешения. |
8. Оценка безопасности наноматериалов в эксперименте на лабораторных животных.
Целью исследования наноматериалов является установление характера и выраженности их повреждающего действия на организм лабораторных животных, установление органотоксичности (нейротоксичность, кардиотоксичность, гепатотоксичность, нефротоксичность, иммунотоксичность и т.д.), критических органов и систем и оценка безопасности наноматериалов.
8.1. Экспериментальные рационы.
В течение всего эксперимента животные имеют свободный доступ к корму и питьевой воде. Кормление осуществляется следующими стандартными рационами вивария, состав которых представлен в таблицах.
Общевиварный рацион крыс (на 1 крысу массой 130 - 240 г). (Согласно приказу Министра здравоохранения СССР N 1179 от 10.10.83).
|
Ингредиент |
Масса, г |
Белок, г |
Жир, г |
Углеводы, г |
Ккал |
|
зерносмесь (подсолнечник, овес) |
3,7 |
0,76 |
1,9 |
0,114 |
22,1 |
|
10,3 |
1,03 |
0,63 |
4,9 |
25,8 |
|
|
хлеб 2 сорта пшеничный |
4 |
0,34 |
0,05 |
1,83 |
9,32 |
|
каша пшенная |
2,5 |
0,27 |
0,34 |
1,56 |
10,5 |
|
творог нежирный |
2 |
0,36 |
0,012 |
0,036 |
1,76 |
|
рыбная мука |
0,5 |
0,23 |
0,027 |
0 |
1,17 |
|
мясо 2 к |
4 |
0,8 |
0,39 |
0 |
6,72 |
|
морковь |
8 |
0,104 |
0,008 |
0,67 |
2,4 |
|
Зелень (салат) |
8 |
0,12 |
0,016 |
0,25 |
1,36 |
|
Рыбий жир |
0,1 |
0 |
0,099 |
0 |
0,9 |
|
дрожжи |
0,1 |
0,05 |
0,01 |
0,083 |
0,085 |
|
NaCl |
0,15 |
|
|
|
|
|
Итого |
43,35 |
4,06 |
3,48 |
9,44 |
82,12 |
Рацион, рекомендованный ГУ НИИ питания РАМН (полусинтетический рацион)
|
Компоненты |
Масса ингредиентов (г на 100 г диеты) |
|
Казеин |
20 |
|
Крахмал |
63,5 |
|
Масло растительное (подсолнечное) |
5 |
|
Лярд |
5 |
|
Солевая смесь |
3,5 |
|
Сухая смесь водорастворимых витаминов |
0,9 |
|
Смесь жирорастворимых витаминов (масляный р - р) |
0,1 мл |
|
Микрокристаллическая целлюлоза |
2 |
Смесь жирорастворимых витаминов
|
Витамины |
Объем (мл на 100 мл смеси) |
|
Е (токоферол 50 мг/мл -) |
10 |
|
А (ретинол-100000 и.е/мл) |
1,4 |
|
D (эргокальциферол 50000 и.е./мл) |
1,4 |
|
Рыбий жир |
87,2 |
Смесь водорастворимых витаминов.
|
NN п/п |
Витамин |
Содержание мг/100 г смеси |
|
1 |
Тиамин гидрохлорид |
500 |
|
2 |
Рибофлавин |
500 |
|
3 |
Пиридоксин гидрохлорид |
500 |
|
4 |
Никотинамид |
2000 |
|
5 |
Кальция пантотенат |
2000 |
|
6 |
Фолаевая кислота |
200 |
|
7 |
Биотин |
10 |
|
8 |
Цианкобаламин |
1,5 |
|
9 |
Викасол (К3) 1% |
100 |
|
10 |
Сахароза |
До 100 г |
Солевая смесь.
|
NN |
Наименование соли |
Содержание г/100 г смеси |
|
1 |
Кальций фосфорнокислый Са3(РО4)2 |
50 |
|
2 |
Натрий хлористый NaCl |
7,4 |
|
3 |
Калий лимонокислый моногидрат С6Н5О7К3×Н2О |
22 |
|
4 |
Калий сернокислый K2SО4 |
5,2 |
|
5 |
Магний окись МgО |
2,4 |
|
6 |
Марганец углекислый (Мn 43 - 48%) |
0,35 |
|
7 |
Железо лимоннокислое C6H5О7Fe (Fe 16 - 17%) |
0,6 |
|
8 |
Цинк углекислый ZnCО3 (Zn 70%) |
0,16 |
|
9 |
Медь углекислая (Сu 53 - 55%) |
0,03 |
|
10 |
Йодистокислый калий КIO3 |
0,001 |
|
11 |
Селенистокислый натрий Na2SeО3 |
0,001 |
|
12 |
Хромовокалиевые квасцы CrK(SO4)2×12Н2O |
0,058 |
|
13 |
Сахароза (высокоочищенная) |
11,8 |
8.2. Схема проведения эксперимента по изучению общетоксического действия наноматериалов.
Изучение острой токсичности проводят после однократного введения исследуемого наноматериала. Количество мелких лабораторных животных в группе должно обеспечить возможность вычисления LD50 (не менее 10). Общая продолжительность наблюдения составляет 14 дней, при этом фиксируются общее состояние животных, характер двигательной активности, состояние волосяного и кожного покрова, реакции на различные раздражители и т.д. Регистрируется гибель животных, при этом у всех погибших животных проводятся макроскопическое и, при необходимости, микроскопическое исследование внутренних органов.
Введение наноматериалов лабораторным животным осуществляют путем, который предполагается при использовании наноматериалов в дальнейшем: предлагаемые для приема внутрь вводятся в составе корма или зондом; для местного применения - наносят на кожу; при ингаляционном введении лабораторных животных помещают в затравочные камеры, снабженные специальными затравочными устройствами. Количество наноматериала рассчитывают на единицу массы тела животного.
Схема эксперимента по общетоксикологической характеристике наноматериалов в не менее чем шестимесячном эксперименте представлена в следующей таблице.
|
Вид животных |
Линейные или беспородные белые крысы самцы, дополнительно - крысы самки |
|
Продолжительность эксперимента |
не менее б месяцев для крыс. |
|
Количество групп животных |
3 |
|
Описание экспериментальных групп |
1-ая (контроль-1) - крысы на протяжении эксперимента находятся на контрольном общевиварном или полусинтетическом рационе и не экспонируются наноматериалами 2-ая (контроль-2) - крысы экспонируются в агравированном количестве изучаемой продукцией, полученной традиционным способом 3-я (опыт) - крысы экспонируются в агравированном количестве изучаемой продукцией, содержащей наноматериалы. |
|
Содержание животных |
по 5 в клетке |
|
Количество забоев |
2 (через 1 и 6 месяцев от начала эксперимента) |
|
Количество крыс в группе на начало эксперимента |
ориентировочно с учетом возможной гибели 36 |
|
Исходная масса крыс |
60 - 80 г при формировании групп разница средней массы крыс не должна превышать 3 г |
|
Количество крыс в группе, взятых на исследование на забое |
8 |
8.2.1. Исследуемые показатели:
Интегральные показатели.
- Общее состояние животных (ежедневные наблюдения).
- Для контроля за массой тела животных взвешивают в первый месяц опыта - 1 раз в неделю, в дальнейшем 1 - 2 раза в месяц и перед забоем.
- На забое определяют абсолютную массу внутренних органов и рассчитывают относительную массу внутренних органов [1].
Биохимические показатели.
Биохимические показатели определяются при забое животных.
|
Показатель |
Метод |
Литературный источник |
|
Сыворотка крови |
||
|
Общий белок |
унифицированный метод по биуретовой реакции |
|
|
альбумин |
унифицированный метод по реакции с бромкрезоловым зеленым |
|
|
белковые фракции |
унифицированный метод электофоретического разделения |
|
|
глюкоза |
глюкозооксидазный метод |
|
|
мочевина |
унифицированный метод по цветной реакции с диацетилмонооксимом |
|
|
креатинин |
унифицированный метод по цветной реакции Яффе с пикриновой кислотой |
|
|
общие липиды |
турбидиметрический |
|
|
холестерин |
унифицированные методы по реакции с уксусным ангидридом или с хлорным железом |
|
|
триглицериды |
спектрофотометрические |
|
|
минеральный состав |
Атомно-абсорбционный |
|
|
аланинаминотрансфераза |
спектрофотометрические |
|
|
аспартатамино-трансфераза |
спектрофотометрические |
|
|
щелочная фосфатаза |
спектрофотометрические |
|
|
глутатионредуктаза глутатионпероксидаза супероксиддисмутаза каталаза |
спектрофотометрические |
|
|
Продукты ПОЛ (малоновый диальдегид, диеновые коньюгаты) |
спектрофотометрические |
|
|
альфа-амилаза |
спектрофотометрические |
|
|
Моча |
||
|
рН, относительная плотность, суточный диурез |
общепринятые |
|
|
белок |
биуретовый метод |
|
|
глюкоза |
унифицированные методы обнаружения глюкозы в моче |
|
|
креатинин |
унифицированный метод по цветной реакции Яффе с пикриновой кислотой |
|
|
Печень |
||
|
цитохром Р-450 |
Спектрофотометрический |
|
|
Цитохром bs |
Спектрофотометрический |
|
|
N-деметилирование амидопирина |
Спектрофотометрический |
|
|
О-деметилирование р-нитроанизола |
Спектрофотометрический |
|
|
Гидроксилирование 3, 4 бензпирена |
Спектрофлюориметрический |
|
|
О-деэтилирование 7-этоксикумарина |
Спектрофлюориметрический |
|
|
О-деэтилирование 7-этоксирезофурина |
Спектрофлюориметрический |
|
|
бета-галактозидаза, бета-глюкуронидаза, арилсульфатазы А и В, альфа-маннозидаза, бета-N-ацетилглюкозаминидаза |
Спектрофотометрический, спектрофлюориметрический |
|
|
эпоксидгидролаза |
Спектрофлюориметрический |
|
|
УДР-глюкуронозилтрансфераза |
Спектрофотометрический и спектрофлюориметрический |
|
Гематологические показатели
|
Показатель |
Метод |
Литературный источник |
|
концентрация гемоглобина |
гемиглобинцианидный |
|
|
Общее количество эритроцитов |
унифицированный метод подсчета в счетной камере |
|
|
гематокритная величина |
унифицированный микрометод (модификация Й. Тодорова) |
|
|
среднее содержание гемоглобина в эритроците (ССЭ) (пг) |
расчетный
|
|
|
средняя концентрация гемоглобина в эритроците (СКЭ) (%) |
расчетный
|
|
|
средний объем одного эритроцита (СОЭ) (мю) |
расчетный
|
|
|
Общее количество лейкоцитов лейкоцитарная формула |
унифицированный метод подсчета в счетной камере, унифицированный метод морфологического исследования форменных элементов крови с дифференцированным подсчетом лейкоцитарной формулы, - приготовление мазков крови унифицированным методом, - фиксация и окраска мазков унифицированным методом. |
8.2.2. Морфологические исследования.
Всех животных, погибших в ходе эксперимента, вскрывают и составляется протокол вскрытия. На забое проводятся морфологические исследования, изложенные в таблице.
|
Исследуемые органы |
Методы |
Литературный источник |
|
все внутренние органы |
макроскопические исследования при вскрытии на забое |
|
|
печень почки селезенка желудок тонкий кишечник семенники поджелудочная железа сердце головной мозг |
1. Обзорные гистологические исследования окраска срезов органов, лученных с парафиновых блоков, гематоксилином и эозином 2. Дополнительные специальные морфологические исследования: - Изучение жировых включений в клетке. Окраска Суданом. - Выявление жирных кислот с помощью сульфата нильского голубого - Выявление холестерина - Выявление в клетках РНК окрашиванием пиронином и метиловым зеленым - Выявление липофусцина в клетках - Выявление коллагеновых волокон в соединительной ткани - Выявление эластических волокон в соединительной ткани - Морфометрический метод исследований размеров площади гистологических структур и их колебаний в патологии |
9. Специальные исследования.
Необходимость проведения тех или иных специальных методов исследования определяется экспертом.
9.1. Изучение влияния наноматериалов на функцию воспроизводства и выявление возможного эмбриотоксического, гонадотоксического и тератогенного действия.
9.1.1. Условия проведения эксперимента.
Исследования проводятся на белых линейных крысах. Животные распределяются на 3 группы, в каждой группе 10 самцов и 25 самок. Исходная масса самок не менее 180 г, исходная масса самцов не менее 200 г. 1-ая контрольная группа крыс (самцы и самки) получает на протяжении всего эксперимента общевиварный или полусинтетический рацион; 2-ая контрольная группа (самцы и самки) получает общевиварный или полусинтетический рацион с включением аналога наноматериала, полученного традиционным способом в агравированном количестве или экспонируется иным методом в зависимости от задач исследования; 3-я (опытная) группа крыс (самцы и самки) получает общевиварный или полусинтетический рацион с включением исследуемого наноматериала в том же количестве, что и крысы 2-ой контрольной группы или экспонируется иным методом в зависимости от задач исследования. Животные находятся на этих рационах 30 дней до спаривания, во время спаривания, беременности, лактации. Полученное потомство находится на этих рационах до момента половой зрелости.
9.1.2. Изучение влияния нанопродуктов на пренатальное развитие потомства.
Для спаривания в клетку к двум самкам подсаживают вечером одного самца, утром осуществляют микроскопирование влагалищных мазков. Первый день беременности определяют по наличию сперматозоидов во влагалищных мазках. По 10 беременных самок из каждой группы забивают на 20-ый день беременности. Плоды извлекают из рогов матки и обследуют визуально для обнаружения видимых аномалий развития, после этого плоды взвешивают. После наружного осмотра плоды каждого помета делят на 2 группы. Одну фиксируют в жидкости Буэна и используют для изучения внутренних органов. Другую фиксируют в 96%-ном этаноле и используют для изучения состояния скелета (2 - 3 плода от приплода) [52] Подсчитывают количество желтых тел, количество мест имплантаций, количество резорбций, количество живых эмбрионов, количество погибших плодов, краниокаудальный размер. Вычисляют общую эмбриональную смертность, смертность эмбрионов до и после имплантации [1].
9.1.3. Изучение влияния наноматериалов на постнатальное развитие потомства.
По 15 беременных самок в каждой группе оставляют до родов и проводят изучение потомства: количество крысят, родившихся у одной самки, их внешний вид, фиксируют количество мертворожденных животных, потомство взвешивают при рождении, затем еженедельно. Учитывают следующие показатели физиологического развития крысят: сроки отлипания ушных раковин, открытия глаз, прорезывания резцов, покрытия шерстью, пол животных [53]. Наблюдения за потомством осуществляют ежедневно. Рассчитывают выживаемость потомства на 30-ый день.
9.2. Исследования возможного мутагенного действия.
Выявление мутагенного действия наноматериалов на соматических и половых клетках проводится на лабораторных животных, а изучение генных мутаций на микроорганизмах или дрозофиле.
Лабораторные животные подвергаются экспозиции наноматериалом или его макродиспесным# аналогом различными путями, в различных количествах и в разные сроки в зависимости от характера опыта.
На подопытных и контрольных животных проводятся исследования:
- цитогенетические исследования метафазным методом в соматических клетках (костный мозг, лимфоциты крови животных);
- изучение генетических изменений в половых клетках методом выявления доминантных летальных мутаций;
- изучение генных мутаций производится по выбору на микроорганизмах или дрозофиле; микробиологические методы используются для первичной оценки на мутагенность. Для этих целей чаще всего используют штаммы микроорганизмов Salmonella thyphimurium [54 - 56].
В зависимости от характера опыта используются следующие животные:
- линейные мыши (С57 В1/6 или другие чувствительные к мутагенам), самцы, вес 18 - 20 г.
- гибридные мыши, самки, вес 18 - 20 г.
Для оценки мутагенного действия испытуемого продукта изучают хромосомные аберрации в клетках костного мозга и доминантные летальные мутации (ДЛМ) в половых клетках подопытных и контрольных животных. Цитогенетические исследования проводят метафазным методом. Согласно методу, животных, получавших испытуемый и контрольный (аналогичный, полученный без использования нанотехнологий) материал, через 24 часа после последнего скармливания забивают (предварительно за 2 часа до забоя вводят внутрибрюшинно колхицин для накопления метафаз) и берут костный мозг из 2-х бедренных костей. После гипотенизации клеток в термостате с помощью 0,5% раствора КСl и фиксации смесью этанол + уксусная кислота готовят цитогенетические препараты. От каждого животного анализируют 70 - 100 клеток на стадии метафазы деления ядра. В опытах используют мышей-самцов линии С57 В1/6 в возрасте 2 месяца, весом около 20 г. Считается, что животные этой линии наиболее чувствительны к мутагенам [57].
Генетические изменения в половых клетках изучают методом выявления доминантных летальных мутаций у мышей-самцов С57В1/6 [57, 58]. Проведение эксперимента: подопытных и контрольных животных обрабатывают испытуемым наноматериалом или его макродисперсным аналогом в течение 30 дней. После периода скармливания 15 подопытных и 13 контрольных самцов ссаживают с интактными виргинными самками линии СВА в соотношении 1:2 с целью их скрещивания. Подсадка самок к подопытным самцам производится еженедельно на протяжении 3-х недель, что дает возможность оценить действие наноматериалов на половые клетки в постмейотическом периоде - сперматиды и зрелые спермии. Отсаженных беременных самок забивают методом смещения шейных позвонков на 15 - 17 день беременности, вскрывают, подсчитывают число желтых тел, количество живых и мертвых эмбрионов. По этим данным рассчитывают индексы мутагенности: доимплантационную, постимплантационную смертность, индуцированную летальность.
В случае необходимости рекомендуется проводить следующие исследования на генные мутации на дрозофиле или микроорганизмах.
- Метод исследования генных мутаций в зародышевых клетках дрозофилы, основанный на определении в Х-хромосоме самцов дикого типа (Д 32) рецессивных летальных мутаций, передающихся через дочерей самкам второго поколения [59, 60].
- Метод выявления на микроорганизмах мутагенной активности наноматериала, подвергнутого метаболическим процессам в организме млекопитающих (тест Эймса и метод промежуточного хозяина) [61, 62].
9.3. Определение аддуктов ДНК
(оценка повреждающего действия на генетический аппарат клеток).
Эксперимент проводится на крысах самцах линии Вистар исходной массы 150 - 180 г. Формируют 3 группы по 10 животных. После 7-дневного карантина животных переводят на общевиварный или полусинтетический рацион, в который добавлен в агравированных количествах исследуемый наноматериал (группа 1), аналогичный материал традиционной дисперсности (группа 2) или ничего не добавлено (группа 3). В зависимости от задач исследования, животные групп 2 и 3 могут экспонироваться исследуемыми материалами другим путем (кожным, ингаляционным). Суточная калорийность и содержание основных пищевых веществ в тестируемых рационах не должны различаться.
По окончании периода кормления у животных собирают суточную мочу, помещая их в обменные клетки.
Примечание: загрязнение мочи фекалиями не допускается!
В случае детекции в системе ВЭЖХ (Phenomenex Luna C18, 4,5×250 мм, 20°С 5 мкм), петля 10 мкм, с электрохимическим детектором, в качестве подвижной фазы используется ацетаммонийный буфер - 95%, ацетонитрил - 5% (изократическое элюирование). Скорость потока подвижной фазы - 1 мл/мин.
Параметры электрохимического детектора: режим постоянного тока, потенциал рабочего электрода ± 0,6 mv. Время удерживания 8-оксо-2-дезоксигуанозина - 9,52 мин.
Перед заколом образец мочи центрифугируется 5 мин. при 13000 об/мин. и отбирается надосадочная жидкость.
Результат количественного определения 8-оксо-2-дезоксигуанозина выдается в мкмоль/моль креатинина.
Расчет содержания 8-гидрокси-2-дезоксигуанозина проводят по высоте пика, после предварительной калибровки детектора по стандартному образцу.
В случае детекции в системе ВЭЖХ с масс-спектрометрическим детектором в аналогичных условиях хроматографирования отслеживают ион с м/з = 168, образуемый распадом иона - предшественника с м/з = 284.
Для анализа с использованием масс-детекции предварительно гомогенизированный образец мочи объемом 3 мл наносят на картридж ТФЭ, кондиционированный порциями по 3 см3 ацетонитрила, метанола и 25 мМ буфера дигидрофосфата калия (рН = 5,5). После промывки 3 см3 25 мМ буфера и 2 мл воды картридж высушивается в токе азота. Далее промывается 2 см3 ацетонитрила. Затем 8-гидрокси-2-дезоксигуанозин элюируится 2 см3 метанола. Элюат упаривается досуха и перерастворяется в 300 мкл 10 мМ ацетата аммония, содержащего 2% метанола (рН = 4,3).
Индивидуальные результаты определения 8-гидрокси-2-дезоксигуанозина, выраженные в мкмоль/моль креатинина, подвергают статистической обработке с помощью критерия Стьюдента и непараметрического рангового критерия Мана-Уитни. Различие между опытной и контрольной группами признается достоверным на уровне значимости Р < 0,05. Расчеты проводят с помощью пакетов программ EXCEL и SPSS версии не старше 9.0.
9.4. Изучение влияния наноматериалов на генотоксичность.
Для оценки влияния наночастиц и продукции, полученной с использованием наноматериалов, на генотоксичность используют метод щелочного гель-электрофореза [63].
9.5. Метод исследования протеомного профиля.
При необходимости проведения исследования потомного профиля тканей и органов лабораторных животных для оценки влияния на биосинтез белков наночастиц и продукции, изготовленной с использованием наноматериалов и нанотехнологий, используется метод масс-спектрометрии высокого разрешения с лазерной ионизацией и десорбцией на матрице (MALDI).
9.6. Оценка потенциальной аллергенности наноматериалов.
Для оценки потенциальной аллергенности в ГУ НИИ питания РАМН разработана экспериментальная модель системной анафилаксии, возникающей у лабораторных животных (крыс) при их внутрибрюшинной сенсибилизации с последующим введением разрешающей дозы гомологичного белкового антигена внутривенно.
Метод исследования заключается в количественной оценке изменений тяжести протекания системной анафилаксии и уровня циркулирующих сенсибилизирующих антител (субклассов lgG1 + lgG4) у крыс, получающих тестируемый продукт, произведенный с использованием нанотехнологий, в сравнении с животными, получающими аналогичный продукт, изготовленный из традиционных источников.
9.6.1. Принцип метода.
Метод основан на количественной оценке тяжести реакции системной анафилаксии, возникающей при внутрибрюшинной (в/б) сенсибилизации взрослых крыс самцов линии "Вистар" пищевым антигеном-овальбумином куриного яйца (ОВА) с последующим внутривенным (в/в) введением сенсибилизированным животным разрешающей дозы того же белка внутривенно.
Определение включает следующие этапы:
- В/б сенсибилизация крыс антигеном - ОВА, адсорбированным на корпускулярном носителе- гидроксиде алюминия.
- Одновременное с процессом сенсибилизации кормление животных рационами, содержащими наноматериалы и контрольными рационами. При необходимости, животные могут экспонироваться тестируемыми материалами через кожу или ингаляционно.
- Взятие крови для определения антител и в/в введение разрешающей дозы ОВА, количественная оценка тяжести развивающегося анафилактического шока.
- Иммуноферментное определение уровней циркулирующих специфических антител к ОВА.
- Математическая обработка результатов исследования и составление заключения о потенциальной аллергенности исследуемого продукта.
9.6.2. Животные.
Исследования выполняют на крысах самцах линии ВИСТАР с исходной массой 150 - 180 г. Животных содержат на стандартном рационе вивария, не содержащем яичного белка, в течение 7 - 10 дней перед началом эксперимента по 5 - 6 животных в клетке. Контролируют массу тела крыс, отстающих в приросте массы тела в течение периода адаптации удаляют.
В течение периода кормления экспериментальным рационом (всего 29 дней) животные получают в составе рациона тестируемый и контрольный продукт в квоте, не превышающей 20% общей калорийности рациона. В зависимости от задач исследования, экспонирование тестируемым и контрольным путем может проводится и другими путями (кожным, ингаляционным).
Формируют 3 группы крыс по 25 животных в каждой. Животных 1-й группы подвергают воздействию наноматериала, животных 2-й группы - его аналога в традиционной форме. Животные 3-й группы получают стандартный рацион вивария. На 1-ый, 3-й, 45-й день опыта крыс в/б сенсибилизируют ОВА, а на 21-й день эксперимента вводят дополнительную ("бустерную") дозу антигена, уменьшенную в 10 раз в сравнении с первоначальной. Кормление рационами продолжают до утра 29-го дня эксперимента. Далее крыс помещают в домики для в/в манипуляций и вводят раствор ОВА в/в, после чего оценивают на протяжении 24 ч тяжесть развивающейся реакции анафилаксии. Непосредственно перед введением разрешающей дозы у крыс отбирают 0,1-0,2 мл крови из хвостовой вены для определения уровня специфических антител.
Примечание. В случае если тестируемые продукты имеют жидкую консистенцию, вместо добавления в диету допускается вводить их ежедневно внутрижелудочно через зонд, снабженный гладкой оливой диаметром не более 2 мм.
9.6.3. Материалы и оборудование.
Овальбумин куриного яйца, ОВА, 5-кратно перекристаллизованный лиофилизированный препарат.
- Раствор хлорида натрия 0,15 моль/л (физиологический раствор).
- Шприц инъекционный "Рекорд" на 1,0 мл с иглой для в/б инъекций*
- Шприц инъекционный "Рекорд" на 20 мл с зондом для в/ж введения.
- Алюмокалиевые квасцы K[Al(SO4)2]×12H2O, препарат квалификации ч.д.а.
- Гидроксид натрия (NaOH), препарат квалификации ч. д. а.
- Центрифуга лабораторная с горизонтальным ротором ОПН-3.
- Универсальный индикатор.
- Домики для в/в манипуляций на крысах, из оргстекла или дерева.
- Шприц инъекционный "туберкулиновый" с иглой для в/в введений.
- Комплект реактивов и оборудования для иммуноферментного анализа.
9.6.4. Приготовление антигена и сенсибилизация.
Навеску 10 мг ОВА растворяют в 1,0 мл физиологического раствора (ФР) и добавляют 1,0 мл 10%-ного водного раствора алюмокалиевых квасцов. На этой стадии раствор должен оставаться прозрачным. После этого добавляют по каплям при перемешивании 0,6 мл водного раствора NaOH 1 моль/л до образования плотного белого осадка. Проверяют рН по универсальному индикатору: рН = 5 ± 1. Осадок отделяют центрифугированием 5 мин при 3000 об/мин. Супернатант декантируют, а осадок промывают 10 мл ФР. Центрифугирование и промывку повторяют 3 раза. Окончательно осадок гидроксида алюминия с адсорбированным ОВА диспергируют в 20 мл ФР.
Полученную дисперсию антигена вводят крысам строго внутрибрюшинно в количестве 0,2 мл (по 100 мкг ОВА в 1 дозе).
Для проведения "бустерной" инъекции готовят антиген по той же схеме, за исключением того, что исходная навеска ОВА уменьшается в 10 раз (1,0 мг).
9.6.5. Введение разрешающей дозы и оценка тяжести реакции системной анафилаксии.
Перед введением разрешающей дозы ОВА крыс помещают в домики для в/в манипуляций. Хвост животного погружают на 10 -15 мин в воду с температурой 37 ± 1°С. С помощью иглы для в/в введений и шприца типа "туберкулиновый" отбирают 0,2 - 0,3 мл крови для определения антител. После этого строго в/в вводят разрешающую дозу 5 мг ОВА в 0,5 мл ФР (10 мг /мл ОВА). Внимание! Подкожное попадание раствора белка не допускается!
Симптомы системной анафилаксии развиваются у крыс, обычно, на протяжении первых 2 - 5 мин после введения разрешающей дозы. Тяжесть реакции оценивают в баллах в соответствии со шкалой (см. таблицу).
|
Тяжесть реакции (баллы) |
Симптоматика |
|
0 |
отсутствует |
|
1 |
вялость, озноб, одышка |
|
2 |
атаксия, цианоз, парез задних конечностей |
|
3 |
судороги, паралич |
|
4 |
летальный исход |
Окончательный подсчет числа летальных исходов осуществляют на протяжении первых 24 часов после введения разрешающей дозы.
9.6.6. Иммуноферментное определение специфических антител.
В основу метода анализа антител к ОВА у крыс положен принцип непрямого твердофазного иммуноферментного теста на полистироле ("Indirect ELISA").
В лунки полистирольных планшет вносят по 1,0 мкг ОВА в 0,1 М Na-бикарбонатном буфере рН 9,7 ± 0,1 и оставляют на 16 ч в холодильнике. По окончании адсорбции антигена буфер удаляют путем промывки 0,01 М Na-фосфатным буфером рН 7,3 ± 0,1 с 0,15 М NaCl и 0,1% Твин-20 (Твин-PBS). В лунки на 30 мин вносят по 200 мкл 1%-ного раствора желатины в Твин-PBS. Отмывку повторяют, после чего вносят в лунки по 100 мкл стандартов крысиных антител к ОВА, очищенных методом аффинной хроматографии, или исследуемых сывороток крови крыс в разведении 1:2000. Разведения выполняют на PBS с 0,2%-ного бычьего сывороточного альбумина (DSA-PBS). Планшеты инкубируют 90 мин при 22°С со встряхиванием, после чего 5-кратно отмывают Твин-PBS и вносят по 100 мкл кроличьих антител к lgG крысы, коньюгированных с пероксидазой, в разведении 1:1000 в BSA-PBS. Инкубацию и отмывку повторяют, после чего проводят реакцию со 100 мкл субстрата 0,04%-ного о-фенилендиамина и 0,04%-ного Н2О2 в 0,1 MNa-цитрат-фосфатном буфере рН 6,00 ± 0,05 в течение 10 мин при 37°С. Реакцию останавливают добавлением 100 мкл 1 М H2SO4 Оптическую плотность измеряют при длине волны 492 нм на фотометре АКИ-Ц-01.
Концентрацию антител определяют по стандартному графику в полулогарифмических координатах методом линейной интерполяции на ЭВМ с использованием пакета программ EXCEL для Windows.
9.6.7. Математическая обработка результатов эксперимента и оценка результата.
Тяжесть реакции анафилактического шока в каждой из групп животных оценивают следующими показателями:
процентом летальных реакций анафилаксии; анафилактическим индексом, рассчитанным по формуле:
![]() , где
, где
N - число крыс в группе;
i - номер крысы;
r - тяжесть реакции анафилаксии в баллах.
Достоверность различия тяжести реакции анафилаксии между двумя группами определяют в соответствии с U-тестом углового преображения Фишера. Для этого для каждого из двух указанных безразмерных показателей (выраженных в долях единицы) рассчитывают преобразованную долю выработки по формуле:
![]() , где
, где
р - долевой показатель;
arcsin - определяется в радианах.
Далее для двух сравниваемых групп N N 1 и 2 рассчитывают величину (U-критерия по формуле:
![]()
Различие по данному показателю признается достоверным (нуль гипотеза отклоняется, Р < 0,04), если U > 1,96.
Достоверность различия распределений животных в сравниваемых группах по тяжести анафилактического шока, выраженной в баллах, дополнительно проверяют с помощью непараметрического рангового теста Мана-Уитни и многомерного непараметрического критерия χ-квадрат.
Различие в тяжести реакции анафилаксии между двумя группами в целом признается достоверным, если достоверно различие хотя бы по одному из перечисленных показателей.
Достоверность различий средних значений и дисперсий уровней антител к ОВА в двух группах определяют, соответственно, с использованием Т-теста Стьюдента и F-теста на остаточную дисперсию Фишера. Анализу подвергают показатели оптической плотности (D492) концентрации антител (мг/мл) и десятичного логарифма концентрации антител.
Все расчеты выполняют на ЭВМ с использованием стандартного пакета программ EXCEL. Для показателя концентрации антител (мг/мл) дополнительно проверяют достоверность различия распределений в сравниваемых группах с использованием непараметрического рангового теста Мана-Уитни.
Все расчеты выполняют на ЭВМ с использованием пакетов программ SPSS (версия не старше 9.0) и EXCEL.
9.7. Иммунологические исследования.
9.7.1. Исследования на крысах.
Исследования проводятся на интактных (не сенсибилизированных) крысах по схеме эксперимента при тех же условиях кормления и содержания животных, что и в разд. 9.6. Через 1 месяц и через 6 месяцев от начала эксперимента определяют следующие показатели:
|
Изучаемые показатели |
Литературный источник |
|
|
Показатели гуморального иммунитета |
Суммарный уровень иммуноглобулинов и количество иммуноглобулинов различных классов |
|
|
Показатели клеточного иммунитета |
Реакция бласттрансформации лимфоцитов in vitro. Реакция торможения миграции лейкоцитов |
|
|
Неспецифические факторы иммунитета |
Система комплемента, белки острой фазы, лизоцим |
|
9.7.2. Исследования на мышах.
Исследование иммуномодулирующего действия наноматериалов на гуморальное звено иммунитета.
Изучение иммуномодулирующего действия наноматериалов на гуморальное звено иммунитета оценивается в тесте определения уровня гемаглютининов к эритроцитам барана. Испытываемые наноматериалы в составе корма, скармливают мышам в течение 21 дня (опытная группа - 10 мышей). При необходимости проводят экспозицию животных тестируемыми материалами кожным или ингаляционным путем. Контролем служат 2 группы мышей (20 мышей). Используются мыши 2-х оппозитных линий: C57BL/6 и СВА. После курса скармливания опытной и одной контрольной группе мышей вводят внутрибрюшинно 0,5 мл эритроцитов барана (концентрация 20 млн клеток/мл), вторая контрольная группа остается интактной. Забор крови проводится на 7, 14 и 21 день. Сыворотку крови титруют в реакции гемагглютинации общепринятым методом [70]. Подсчитывают среднее арифметическое титров гемагглютининов в каждой группе мышей. Иммуномодулирующее действие аналога наноматериала в традиционной макродисперсной форме проводят по той же схеме.
Изучение иммуномодулирующего действия наноматериалов на клеточное звено иммунитета.
Изучение иммуномодулирующего действия наноматериалов на клеточное звено иммунитета определяют в реакции гиперчувствительности замедленного типа (ГЗТ) к эритроцитам барана. Используются мыши двух оппозитных линий. Испытываемые наноматериалы в составе корма скармливают мышам в течение 21 дня (опытная группа мышей - 10), или экспонируют кожным или ингаляционным путем. После курса скармливания опытной и одной контрольной группе вводят подкожно в межлопаточную область эритроциты барана в дозе 1 млн клеток на мышь в объеме 0,1 мл. Вторая контрольная группа остается интактной. На пятый день всем мышам в подушечку одной задней лалы вводят разрешающую дозу эритроцитов барана в концентрации 109 клеток на мышь в объеме 0,02 мл. В контрлатеральную подушечку лапы в том же объеме - 0,95%-ный раствор натрия хлорида. Местную воспалительную реакцию оценивают через 18 - 20 часов путем определения веса опытной и контрольной лапок. Интенсивность местной реакции определяют по индексу реакции [71].
По аналогичной схеме исследуют материал-аналог наноматериала в макродисперсной форме.
Изучение наноматериалов в тесте чувствительности мышей к гистамину.
Используются мыши линии С57 BL/6. Испытываемые наноматериалы, скармливают опытной группе (10 мышей) в течение 21 дня (или при необходимости экспонируют кожным или ингаляционным путем). Контрольная группа - 10 мышей получает стандартный рацион вивария. После курса скармливания опытной и контрольной группам мышей вводят внутрибрюшинно гистамии гидрохлорид в дозе 2,5 мг на мышь в объеме 0,5 мл физиологического раствора. Реакцию учитывают через 24 ч по % гибели мышей.
Изучение влияния наноматериалов на естественную резистентность мышей к сальмонеллам мышиного тифа.
Изучение влияния продукта на естественную резистентность мышей к сальмонеллам мышиного тифа проводят на модели внутрибрюшинного заражения мышей линии C57BL/6 десятикратно отличающимися дозами S. typhimurium штамм 415. Испытываемые наноматериалы в составе корма скармливают мышам в течение 21 дня (или при необходимости экспонируют кожным или ингаляционным путем). Опытная и контрольная группы составляют по 30 мышей. После курса скармливания мышей заражают тремя дозами культуры: от 1000 до 10 микробных клеток на мышь (соблюдая 10-кратный интервал). Наблюдение за животными производится в течение 14 дней. Рассчитывают LD50 в опытной и контрольной группе, % гибели животных по каждой дозе и проводят сравнительный анализ результатов. барьерной функции желудочно-кишечного тракта у не сенсибилизированных животных.
9.8. Оценка
Для оценки влияния на организм наноматриалов в ГУ НИИ питания РАМН разработана экспериментальная модель оценки барьерной функции желудочно-кишечного тракта (ЖКТ), основанная на иммунохимической регистрации поступления в кровь животных белкового антигена, вводимого перорально.
Метод исследования заключается в количественной оценке концентрации в сыворотке крови овальбумина куриного яйца через 3 часа после его внутрижелудочного зондового введения крысам, получающим в составе рациона тестируемый продукт, в сравнении с животными, получающими аналогичный продукт, не содержащий наноматериалы.
9.8.1. Принцип метода.
Метод основан на определении с помощью двухвалентного твердофазного иммуноферментного теста ("Sandwich-ELISA") нерасщепленных молекул овальбумина куриного яйца (ОВА), проникшего через барьер желудочно-кишечного тракта в кровь (системную циркуляцию) после внутрижелудочного зондового введения этого белка в водно-солевом растворе.
Определение включает следующие этапы:
- кормление животных рационами, содержащими наноматериалы и контрольными рационами,
- внутрижелудочное зондовое введение ОВА в физиологическом растворе,
- взятие крови из вены и получение сыворотки,
- иммуноферментное определение концентрации ОВА,
- математическая обработка результатов исследования и составление заключения о влиянии исследуемого наноматериала на проницаемость кишечного барьера для белкового антигена в отсутствие сенсибилизации.
9.8.2. Животные.
Исследования выполняют на крысах самцах линии ВИСТАР с исходной массой 150 - 180 г. Животных содержат на стандартном рационе вивария, не содержащем компонентов куриных яиц, в течение 7 - 10 дней перед началом эксперимента по 5 - 6 животных в клетке. Контролируют массу тела крыс, отстающих в приросте массы тела в течение периода адаптации удаляют.
В течение периода кормления экспериментальным рационом (всего 29 дней) животные получают в составе рациона наноматериалы и аналоги киноматериалов в традиционной форме (не более 20% общей калорийности рациона, если наноматериалы имеют калорийность).
Формируют 3 группы крыс по 10 животных в каждой. Животные 1-й группы и течение 29 дней получают в составе корма тестируемые наноматериалы, животные 2-й группы - аналог наноматериалов в традиционной форме, животные 3-й группы находятся на стандартном рационе вивария.
Примечание. В случае если тестируемые наноматериалы имеют жидкую консистенцию, вместо добавления в корм допускается вводить их животным ежедневно внутрижелудочно через зонд, снабженный гладкой оливой диаметром не более 2 мм.
9.8.3. Нагрузочный тест с овальбумином.
По окончании периода кормления крыс лишают корма в течение 16 часов в клетках с сетчатым дном. Доступ к воде не ограничивают. В период между 8 и 10 ч. утра крысам с интервалами в 5 минут вводят внутрижелудочно через зонд 10% раствор ОВА (5-кратно перекристаллизованный препарат) в 0,15 М NaCl из расчета 3 г белка на 1 кг массы тела.
Примечание.
1) Временные интервалы введения препарата существенны, так как барьерная функция ЖКТ подвержена циркадным колебаниям в течение суток.
2) В ходе введения препарата последовательно чередуют животных из опытной и контрольной группы в целях рандомизации протокола опыта.
3) Категорически не допускается попадание раствора белка на внешнюю поверхность тела животных, материалы клетки и лабораторного оборудования.
Ровно через 2 ч 55 мин после введения препарата белка крыс подвергают анестезии диэтиловым эфиром, обрабатывают брюшную стенку спиртом, вскрывают брюшную полость и собирают кровь из нижней полой вены в чистую стеклянную пробирку, предварительно обработанную в сухожаровом шкафу 2 ч при 160°С. После формирования сгустка фибрина его обводят спицей из нержавеющей стали или тонкой стеклянной палочкой и оставляют на 3 часа для коагуляции при комнатной температуре. Собирают сыворотку крови (гемолиз не допускается!) и осветляют центрифугированием 15 мин при 2000 g в настольной лабораторной центрифуге. Сыворотку хранят до анализа в полиэтиленовых пробирках при -20°С.
Примечание: в/ж введение ОВА и забой животных проводят в разных помещениях, во избежание контаминации образцов раствором ОВА.
Материалы и оборудование для проведения нагрузочной пробы на животных.
- Овальбумин куриного яйца, ОВА, 5-кратно перекристаллизованный лиофилизированный препарат.
- Раствор хлорида натрия 0,15 моль/л в дистиллированной воде (физиологический раствор).
- Шприц инъекционный "Рекорд" на 20,0 мл с зондом, снабженным оливой диаметром не более 2 мм для в/ж введения
- Пробирки стеклянные конические на 10 мл для взятия крови
- Сухожаровой шкаф
- Пробирки полиэтиленовые на 1,5 - 3 мл для хранения сыворотки
- Центрифуга лабораторная с горизонтальным ротором ОПН-3.
- Автоматическая пипетка на 1,0 мл для отбора сыворотки.
- Комплект реактивов и оборудования для иммуноферментного анализа (см. ниже).
9.8.4. Иммуноферментное определение овальбумина.
Метод основан на взаимодействии иммобилизованных на полистироле кроличьих моноспецифических антител против овальбумина куриного яйца (ОВА) с молекулами этого антигена, находящимися в составе сыворотки животных, которым за 3 часа до взятия крови из вены была дана пищевая нагрузка раствором ОВА. После образования двойного иммобилизованного комплекса антитело-ОВА его количественно выявляют с помощью антител против ОВА, предварительно конъюгированных с ферментом пероксидазой. Связавшуюся пероксидазную метку количественно оценивают в реакции хромогенного субстрата - орто-фенилендиамина с перекисью водорода при рН 6,0. Содержание ОВА в пробе определяют по калибровочной кривой, которую получают с использованием стандарта - высокоочищенного ОВА, растворенного в нормальной крысиной сыворотке.
Список оборудования и реактивов для проведения иммуноферментного анализа.
а) Оборудование
- Фотометр планшетный автоматический "ЭФОС 9305" (производства "ОАО МЗ Сапфир", Россия) с интерференционным светофильтром на длину волны 492 нм или аналогичный прибор других изготовителей.
- Воздушный термостат на температуру +37°С.
- Водяная баня на температуру +37°С.
- Лабораторный настольный встряхиватель.
- Автоматическое или ручное устройство для отмывки лунок иммуноферментных планшет на 8 или 12 каналов.
- Весы аналитические лабораторные электронные с верхним пределом взвешивания 120 г 2-го класса точности ±0,1 мг с метрологическими характеристиками по ГОСТ 24104.
- Весы технические лабораторные электронные с верхним пределом взвешивания 120 г и ценой деления 0,01 г.
- Иономер универсальный ЭВ-74 со стеклянным электродом (или аналог).
- Секундомер.
- Пипетка полуавтоматическая 8-канальная регулируемая на объем 20 - 200 мкл с наконечниками.
- Пипетки полуавтоматические 1-канальные на объемы 0 - 20; 20 - 200 и 200 - 1000 мкл с наконечниками.
- Дистиллятор лабораторный.
- Магнитная мешалка.
- Колбы мерные наливные на объемы 500, 1000 и 2000 см3 по ГОСТ 1770.
- Цилиндры мерные на 25, 50, 100 см3 по ГОСТ 1770.
- Стаканы стеклянные на 500 и 1000 см3
- Шприц на объем 2 см3
б) Реактивы
- Кроличьи моноспецифические антитела против ОВА, лиофилизованные.
- Кроличьи моноспецифические антитела против ОВА, меченные пероксидазой, лиофилизованные.
- Нормальный (неиммунный) гамма-глобулин кролика.
- Овальбумин куриного яйца пятикратно перекристаллизованный, лиофилизованный.
- Сыворотка крови интактных крыс.
- Нормальная лошадиная сыворотка.
- Фосфат калия однозамещенный, квалификации х.ч.
- Фосфат калия двузамещенный трехводный, квалификации х.ч.
- Хлорид натрия, х.ч. по ГОСТ 4233-77
- Лимонная кислота тригидрат х.ч.
- Фосфат натрия двузамещенный 12-водный, х.ч. по ГОСТ 4172-76
- Кислота серная d = 1,84 по ГОСТ 4204-77, квалификации х.ч.
- Гидроксид натрия гранулированный х.ч. по ГОСТ 4328-77 или импортный аналог "Analytical grade".
- Натрий двууглекислый безводный х.ч. по ГОСТ 4201-66.
- Твин-20 (полиоксиэтиленсорбитан монолаурат) импортный реактив "Analytical grade" производства "Serva", Германия, катал. N А-37470 или аналог.
- Орто-фенилендиамин, импортный реактив "Analytical grade".
- Перекись водорода "медицинская" 33% по ТУ 6-02-570-75.
- Желатина ("Пищевая", марки П-11, по ГОСТ 11293-89).
- Планшеты полистирольные сплошные или разборные плоскодонные со "средней" степенью связывания, отечественного производства или импортный аналог.
Приготовление рабочих растворов.
- Буфер для иммобилизации антител. Навеску 4 г гидроксида натрия х.ч. переносят в мерную колбу на 100 см3, растворяют и доводят дистиллированной водой до метки. Навеску 8,4 г натрия двууглекислого помещают в стакан на 1000 см3, растворяют в 800 - 900 см дистиллированной воды на магнитной мешалке. Добавляют раствор гидроксида натрия при перемешивании под контролем иономера ЭВ-74 до достижения рН 9,2 ± 0,1. Смесь количественно переносят в мерную колбу на 1000 см3 и доводят водой до метки.
- Фосфатно-солевой буфер (PBS). Навеску 68 г калия фосфата однозамещенного, взятую на технических весах, переносят в мерную колбу на 500 см3, растворяют и доводят дистиллированной водой до метки. Навеску 223 г калия фосфата двузамещенного трехводного, взятую на технических весах, переносят в мерную колбу на 1000 см3, растворяют и доводят дистиллированной водой до метки. Полученные растворы смешивают под контролем иономера ЭВ-74 до достижения величины рН = 7,95 ± 0,05. Навеску 180 г натрия хлорида переносят в мерную колбу на 1000 см3, растворяют и доводят дистиллированной водой до метки. В мерную колбу на 2000 см3 вносят мерным цилиндром 20 см3 смеси раствора фосфатов и 100 см3 раствора натрия хлорида и доводят дистиллированной водой до метки.
- Раствор Твин-PBS. В мерную колбу на 2000 см3 вносят с помощью шприца 2 см3 Твин-20 и доводят PBS до метки.
- Раствор НЛС-PBS. 100 см3 PBS смешивают с 1 см3 нормальной лошадиной сыворотки.
- Блокирующий реагент. 0,2 г желатины смешивают 20 см3 PBS, оставляют на 16 ч в холодильнике, после чего нагревают при +37°С на водяной бане до полного растворения.
- Субстратный буфер. В стакан на 1000 см3 вносят навески 26,3 г натрия фосфорнокислого двузамещенного 12-водного и 5,6 г лимонной кислоте тригидрата (навески готовят на технических весах). Растворяют на магнитной мешалке в 800 - 900 см3 дистиллированной воды, количественно переносят в мерную колбу на 1000 см3, доводят до метки и проверяют на иономере ЭВ-74 рН, который должен составлять 6,0 ± 0,1.
- Раствор субстрата (готовится непосредственно перед употреблением). Навеску 6,0 ± 0,1 мг орто-фениландиамина, взятую на аналитических весах, растворяют при нагревании до 40 - 50°С в 15 см3 субстратного буфера и непосредственно перед нанесением на планшету вносят 40 мкл перекиси водорода, разведенной 1:1 дистиллированной водой.
- Останавливающий реагент (фиксатор). В мерную колбу на 1000 см3 вносят 900 - 950 см3 дистиллированной воды и отмеряют цилиндром 28 см серной кислоты. Раствор перемешивают, охлаждают до комнатной температуре и доводят водой до метки.
Приготовление стандарта.
Навеску 3 - 5 мг ОВА берут на аналитических весах с точностью ±0,1 мг. Белок помещают в пенициллиновый флакон и добавляют PBS из расчета, чтобы концентрация белка составила 1 мг/мл. В коническую пробирку автоматической пипеткой вносят 0,99 см НЛС-PBS и 0,01 см раствора ОВА. Раствор перемешивают, отбирают аликвоту 0,05 см и переносят в пробирку с 0,95 см3 нормальной крысиной сыворотки. Полученный раствор титруют в серии двоичных разведений с помощью полуавтоматической пипетки в ряду из 10 пробирок в нормальной крысиной сыворотке. При этом концентрация ОВА в растворах стандарта составляет от 1,0 до 500 нг/мл (см. таблицу 1)
Таблица 1. Стандарты ОВА
|
NN п/п |
Стандарт |
ОБА, нг/мл |
|
1 |
S10 |
500 |
|
2 |
S9 |
250 |
|
3 |
S8 |
125 |
|
4 |
S7 |
62,5 |
|
5 |
S6 |
31,2 |
|
6 |
S5 |
15,6 |
|
7 |
S4 |
7,8 |
|
8 |
S3 |
3,9 |
|
9 |
S2 |
2,0 |
|
10 |
S1 |
1,0 |
|
11 |
S0 |
0,0 |
Сенсибилизация планшет.
Готовят раствор немеченых антител к ОВА в PBS концентрацией 1 мг/мл. Непосредственно перед нанесением на планшеты раствор разводят буфером для иммобилизации в отношении 1:100 и немедленно вносят в лунки планшет в объеме 0,1 см3. Планшеты оставляют на 16 часов в холодильнике при +2 - 8°С для завершения адсорбции. Далее лунки троекратно промывают Твин-PBS. В лунки планшет вносят по 200 мкл блокирующего реагента и помещают на 0,5 ч на встряхиватель. Далее раствор из лунок выливают и промывку Твин-PBS повторяют. Остатки жидкости удаляют из лунок вытряхиванием на марлевую подушечку. Планшеты готовы к работе. В части лунок планшеты по аналогичной методике вместо антител к ОВА иммобилизуют нормальный гамма-глобулин кролика.
Иммуноферментный анализ.
В лунки планшеты, сенсибилизированные антителами к ОВА, вносят в 2 репликах следующие растворы в объеме 0,1 см3:
- Стандарты в последовательности от S0 до S10 в двух повторах.
- Исследуемые пробы сыворотки крыс в двух повторах.
- В лунки планшеты, сенсибилизированные нормальным гамма-глобулином кролика, вносят те же образцы сывороток крыс, что и в лунки с антителами к ОБА также в двух повторах.
Планшеты инкубируют 2 часа на встряхивателе при комнатной температуре, пятикратно отмывают лунки Твин-PBS и вносят по 0,1 см3 раствора антител к ОВА, конъюгированных с пероксидазой, в разведении 1:2000 в НЛС-PBS. Инкубацию и отмывку повторяют. Избыток жидкости из лунок тщательно удаляют вытряхиванием на марлевую подушечку и вносят по 0,1 см раствора субстрата. Инкубируют 20 мин (по секундомеру) при температуре +37°С в воздушном термостате (в темноте), после чего вносят по 0,1 см3 останавливающего реагента. Планшеты фотометрируют на приборе ЭФОС 9305
Расчт результата
Для каждого стандарта рассчитывают величину связывания Вст = (D1 + D2)/2 - (Dо1 - Dо2)/2, где D - оптическая плотность в лунке стандарта в двух повторах, Dо - оптическая плотность в лунке нулевой пробы (S0) в двух повторах. Строят стандартный график в координатах: десятичный логарифм концентрации ОВА, нг/мл (ось абсцисс) - Вст (ось ординат).
Для каждой пробы сыворотки рассчитывают связывание Вп = (D1 + D2)/2 - (NSB1 - NSB2)/2, где D - оптическая плотность в лунке образца, сенсибилизированной антителами к ОВА, в двух повторах, NSB - оптическая плотность в лунке образца, сенсибилизированной нормальным гамма-глобулином кролика, в двух повторах. По стандартному графику для каждой данной Вп находят концентрацию овальбумина в пробе, в нг/мл. В случае если эта концентрация оказывается ниже 1 нг/мл, результат считается не значимым (овальбумин не обнаружен). В случае, если концентрация ОВА превышает 500 нг/мл, пробу разбавляют в 10 раз нормальной крысиной сывороткой и анализ повторяют.
Метрологические характеристики теста.
Чувствительность метода составила 1,0 нг/мл; тест на открытие 92%, коэффициент корреляции для параллельных проб в пределах одного анализа составил +0,983, коэффициент вариации для одного анализа - 28%, а для разных анализов (по разным стандартным кривым) 39%.
9.8.5. Математическая обработка результатов тестирования.
Достоверность различий средних значений и дисперсий уровней ОВА в двух группах крыс определяют, соответственно, с использованием Т-теста Стьюдента и теста на остаточную дисперсию ANOVA. Достоверность различия функции распределения показателей в двух группах проверяют с использованием непараметрического рангового U-теста Мана-Уитни. Все расчеты выполняют на ЭВМ с использованием стандартного пакета программ SPSS версии не старше 9.0 Гипотеза о неразличимости сравниваемых групп (нуль-гипотеза) отвергается (различие признается достоверным) на уровне значимости Р < 0,05. Две сравниваемые группы признаются достоверно различными, если по результатам хотя бы одного из указанных тестов нуль-гипотеза отвергается.
9.9. Оценка барьерной функции желудочно-кишечного тракта у сенсибилизированных животных.
В случае, если влияние тестируемых наноматериалов на проницаемость барьера желудочно-кишечного тракта для белковых макромолекул у нормальных лабораторных животных не было выявлено, наличие возможного эффекта должно быть проверено у сенсибилизированных крыс в состоянии легкой системной анафилаксии. При этом использование ОВА в качестве индикатора кишечной проницаемости не представляется возможным, т.к. этот же белок используется при сенсибилизации, и в сыворотке крови животных присутствуют в высоких титрах антитела к ОВА, способные исказить результаты иммуноферментного определения. Ввиду этого, в качестве индикатора проницаемости кишечного барьера используется не метаболизируемый в организме полимер - полиэтиленгликоль-4000 (ПЭГ).
Метод исследования заключается в количественной оценке экскреции с мочой ПЭГ в течение 24 часов после его внутрижелудочного зондового введения сенсибилизированным ОВА крысам, получающим в составе корма наноматериалы, в сравнении с животными, получающими аналогичный продукт в традиционном виде, не содержащем наноматериалы, на фоне протекания мягкой формы реакции системной анафилаксии.
9.9.1. Принцип метода.
Метод основан на определении с помощью высокоэффективной жидкостной хроматографии ПЭГ, проникшего через барьер ЖКТ в кровь и экскретированного с мочой в течение суток после внутрижелудочного зондового введения этого полимера в водно-солевом растворе.
Определение включает следующие этапы:
- содержание животных на рационах, содержащих тестируемые наноматериалы и аналоги наноматериалов в традиционной форме в течение 29 дней.
- сенсибилизацию животных опытной и контрольной групп овальбумином по схеме, применяемой при воспроизведении реакции системной анафилаксии (см. п. 9.6.).
- в/в введение разрешающей дозы ОВА в физиологическом растворе.
- в/ж введение ПЭГ
- раздельный сбор мочи и кала в течение суток в обменных клетках
- определение содержания ПЭГ в моче методом ВЭЖХ и креатинина колориметрическим методом Яффе
- математическая обработка результатов исследования и составление заключения о влиянии исследуемого наноматериала на проницаемость кишечного барьера в присутствии сенсибилизации.
9.9.2. Животные.
Исследования выполняют на крысах самцах линии ВИСТАР с исходной массой 150 - 180 г. Животных содержат на стандартном рационе вивария, не содержащем компонентов куриных яиц, в течение 7 - 10 дней перед началом эксперимента по 5 - 6 животных в клетке. Контролируют массу тела крыс, отстающих в приросте массы тела в течение периода адаптации удаляют.
В течение периода кормления экспериментальным рационом (всего 29 дней) животные получают в составе рациона тестируемые наноматериалы и аналоги наноматериалов в традиционной форме (не более 20% общей калорийности рациона, если наноматериалы имеют калорийность).
Формируют 3 группы крыс по 10 животных в каждой. Животные 1-й группы в течение 29 дней получают в составе корма тестируемые наноматериалы, животные 2-й группы - аналоги наноматериалов в традиционной форме, животные 3-й группы - стандартный рацион вивария.
Примечание. В случае если тестируемые наноматериалы имеют жидкую консистенцию, вместо добавления в корм допускается вводить их животным ежедневно внутрижелудочно через зонд, снабженный гладкой оливой диаметром не более 2 мм.
На протяжении последних 28 дней эксперимента животных сенсибилизируют ОВА по схеме, приведенной в п. 9.6.
По окончании периода сенсибилизации в период с 8 до 10 часов утра животным вводят в/в (в хвостовую вену) разрешающую дозу ОВА в 0,15 М NaCl (физиологическом растворе) из расчета 3 мг/кг массы тела. Немедленно после этого крысам вводят в/ж раствор ПЭГ в 0,15 М NaCl концентрацией 10% из расчета 3 г ПЭГ на 1 кг массы тела. Животных помещают в обменные клетки и осуществляют сбор мочи в течение 24 часов.
Примечания.
1) Временные интервалы введения разрешающей дозы ОВА и препарата ПЭГ существенны, так как барьерная функция ЖКТ подвержена циркадным колебаниям в течение суток.
2) В ходе введения препарата последовательно чередуют животных из опытной и контрольной группы в целях рандомизации протокола опыта.
3) Категорически не допускается попадание раствора ПЭГ на внешнюю поверхность тела животных, материалы обменной клетки и лабораторного оборудования.
4) Введение ПЭГ и сбор мочи осуществляют в разных помещениях, во избежание контаминации образцов раствором ПЭГ.
5) Не допускается загрязнение образцов мочи калом животных.
Материалы и оборудование для проведения нагрузочной пробы на животных
- Овальбумин куриного яйца, ОВА, 5-кратно перекристаллизованный лиофилизированный препарат.
- Раствор хлорида натрия 0,15 моль/л в Дистиллированной воде (физиологический раствор).
- ПЭГ-4000, импортный препарат квалификации "Analytical grade".
- Шприц инъекционный "Рекорд" на 1,0 мл для введения сенсибилизирующих доз антигена
- Шприц инъекционный "туберкулиновый" для в/в введения разрешающей дозы антигена
- Шприц инъекционный "Рекорд" на 20,0 мл с зондом, снабженным оливой диаметром не более 2 мм для в/ж введения ПЭГ
- Центрифуга лабораторная с горизонтальным ротором ОПН-3.
- Пробирки стеклянные конические центрифужные.
- Пробирки или флаконы полиэтиленовые на 10 см3 для хранения образцов
- Домики для в/в манипуляций на крысах из оргстекла или дерева.
- Обменные клетки для раздельного сбора кала и мочи.
- Мерный цилиндр на 10 см3 с ценой деления 0,1 см3.
- Комплект реактивов и оборудования для экстракции, ВЭЖХ и колориметрического анализа (см. ниже).
Немедленно по окончании сбора мочи ее объем измеряют мерным цилиндром с точностью ±0,1 мл. Мочу перемешивают, переливают в конические пробирки и центрифугируют при ускорении 2000g 15 минут. Супернатант переносят в полиэтиленовые пробирки и хранят до анализа при -20°С.
Примечание. При очень малом (менее 1 см3) объеме суточной мочи крысам вводят в/ж по 10 см3 дистиллированной воды и продолжают сбор мочи еще 2 - 3 часа.
9.9.3. Анализ образцов мочи.
Материалы и оборудование.
- Роторный испаритель
- Колонка хроматографическая TSK GEL G2000 SWLX (HP, США), или аналогичная гель-фильтрующая высокоэффективная колонка той же пористости других производителей.
- Жидкостный хроматограф высокого давления в комплекте (инжектор, нанос, рефрактометрический детектор).
- Шприц на 0,01 - 0,1 см3 для нанесения образца на колонку
- Фильтр с размером пор 1 мкм для фильтрации элюента
- Ультразвуковая ванна для дегазации элюента
- Пипетки полуавтоматические 1-канальные на объемы 0 - 20; 20 - 200 и 200 - 1000 мкл с наконечниками.
- Дистиллятор лабораторный.
- Колбы мерные наливные на объемы 500, 1000 см по ГОСТ 1770.
- Цилиндры мерные на 50 и 100 см3 по ГОСТ 1770.
- Спектрофотометр СФ-46 (ЛОМО, РФ) или фотоэлектроколориметр КФК-3 или аналогичные приборы других производителей.
- Кюветы спектрофотометрические кварцевые с длиной оптического пути 1 см.
- Секундомер.
б) Реактивы
- ПЭГ-4000 для получения стандартов импортный препарат "Analytical grade"
- Хлороформ квалификации ХЧ используется непосредственно или квалификации ЧДА после однократной перегонки при атмосферном давлении.
- Натрий сернокислый безводный, ХЧ.
- Метанол квалификации ХЧ используется непосредственно или квалификации ЧДА после однократной перегонки при атмосферном давлении.
- Гидроксид натрия гранулированный ХЧ по ГОСТ 4328-77 или импортный аналог "Analytical grade"
- Пикриновая кислота импортный препарат "Analytical grade"
- Трихлоруксусная кислота ХЧ или импортный препарат "Analytical grade"
- Креатинин импортный препарат "Analytical grade"
Аналитическое определение ПЭГ.
Аликвоту мочи объемом 1 см3 экстрагируют объемом 10 см3 хлороформа в течение 10 минут при энергичном встряхивании. Хлороформенные вытяжки высушивают при добавлении безводного сульфата натрия и отгоняют растворитель на роторном испарителе. Остаток растворяют в 0,1 см3 смеси метанол-вода 1:1 по объему. Аликвоту раствора 10 - 20 мкл наносят на колонку TSK GEL G2000 SWLX (HP, США), 0,8×30 см, уравновешенную смесью метанол-вода 1:1. Колонку элюируют изократически со скоростью 0,3 мл/мин смесью метанол-вода указанного состава. Пик ПЭГ в элюате детектируют с помощью рефрактометрического детектора и идентифицируют по объему выхода стандарта. Площадь хроматографических пиков определяют как произведение их высоты на ширину, измеренную на 1/2 высоты пика. Стандартный график зависимости площади пика от массы аналита строят по методу наименьших квадратов с использованием пакета программ EXCEL для Windows. При этом линейность сохраняется в диапазоне 10 - 400 мкг ПЭГ-4000 в пробе, чувствительность метода составляет 5 мкг, открываемое количество ПЭГ-4000 в моче - 96% от теоретического.
Оценка экскреторной функции почек.
Величина оценки всасывания ПЭГ-4000 по его экскреции с мочой может находиться в зависимости от экскреторной функции почек. Для того чтобы исключить влияние данного фактора на получаемые данные, величину экскреции ПЭГ-4000 выражают в расчете на 1 ммоль экскретируемого за тот же период времени креатинина.
Концентрацию креатинина в моче определяют с помощью колориметрического метода Яффе в модификации Покровского А.А. [7, 8]. Стандарты получают, растворяя рассчитанные количества креатинина в воде. Пробы мочи перед анализом разводят водой в отношении 1:100. В пробирки вносят по 500 см3 разведенных опытных или стандартных проб, 2SО см3 воды, 250 см3 20% ТХУ и 500 см3 1% водного раствора пикриновой кислоты. После этого по секундомеру добавляют по 500 см3 0,75 и NaOH и ровно через 20 мин измеряют оптическую плотность при длине волны 500 нм на фотоэлектроколориметре или спектрофотометре в стеклянной или кварцевой кювете с длиной оптического пути 1 см. Стандартный график строят по методу наименьших квадратов с использованием пакета программ EXCEL для Windows; вычисляют пересчетный угловой коэффициент в координатах концентрация-оптическая плотность и определяют содержание креатинина в пробах расчетным методом. Линейность и чувствительность метода должны отвечать данным руководства [7, 8].
9.9.4. Расчет и оценка результатов исследования.
Экскрецию ПЭГ с суточной мочой в% от в/ж введенной дозы рассчитывают по формуле:
Е[%] = m×(V×0,l/w)×(1/10),
где m - количество ПЭГ в хроматографическом пике, рассчитанное по стандартной кривой и выраженное в мг;
V - объем суточной мочи в см3;
w - количество экстракта мочи, наносимого на колонку, в см3.
Экскрецию креатинина рассчитывают по формуле:
К[ммоль] = С×V/1000,
где С - концентрация креатинана в моче, выраженная в ммоль/л.
Удельную экскрецию креатинина рассчитывают по формуле:
ЕS[%/ммоль] = Е/К
Последний показатель подвергают статистической обработке в двух группах животных. Используют те же методы статистической обработки, что и при сравнении групп несенсибилизированных животных по показателю всасывания овальбумина (см. п. 9.8.)
9.10. Методы оценки состояния микробиоценоза желудочно-кишечного тракта.
9.10.1. Изучение взаимодействия, нормофлоры желудочно-кишечного тракта с наноматериалами в модели in vitro.
Для изучения биосовместимости нормофлоры желудочно-кишечного тракта с наноматериалами используется экспериментальная модель in vitro (далее "модель") изолированных ведущих представителей защитной микрофлоры кишечника человека (бифидобактерий, лактобацилл и энтеробактерий).
Испытуемые наноматериалы вносят в среды культивирования для указанных культур микроорганизмов, предварительно раститрованных от максимального до минимального содержания в 1 мл среды, выдерживают при оптимальных условиях инкубации и изучают морфологические, кинетические, функциональные и количественные параметры роста культур в присутствии наноматериала и без него (контроль).
В качестве тест-микроорганизмов используют стандартизованные коммерческие препараты пробиотиков на основе чистых культур человеческого происхождения без добавлений пребиотических и других стимулирующих компонентов, соответствующие требованиям 3.3.2.684-98 "Производство и контроль медицинских иммуннобиопрепаратов": лактобактерин на основе Lactobacillus plantarum и fermentii и/или аципол на основе Lactobacillus acidophilus; бифидумбактерин на основе Bifidobacterium bifidum шт. 1,791 или ЛВА-3; колибактерин на основе E. coli M-17 и т.п.
Модель составляется из параллельных рядов опытных и контрольных пробирок с последовательными десятичными разведениями вышеперечисленных пробиотиков в соответствующих питательных средах: обезжиренное стерилизованное молоко и среда МРС для лактобацилл, среда Бактофок для бифидобактерий, среда Кесслер и Эндо для E.coli. Культуры разводят до значения, на два-три порядка превышающего их предварительно установленную предельную концентрацию в препарате.
В опытные ряды вносят испытуемые наноматериалы в различных предварительно рассчитанных концентрациях; в контрольных рядах остаются только разведения пробиотиков. Культивирование проводят при (37 ± 0,5) С в течение 24 - 72 час.
Расчет концентраций вносимых в модель наноматериалов производят, используя принцип "Потребляемая суточная доза/объем желудка взрослого человека", принимая за средний объем желудка взрослого человека величину 2250 см3. Таким образом, конечные концентрации наноматериалов в каждой пробирке ряда с разведениями тест-пробиотика должны составлять величину, условно принимаемую за поступившую в желудочно-кишечный тракт человека в день. В каждую пробирку каждого опытного ряда рассчитанная концентрация испытуемых наноматериалов вносится в виде дисперсии в водной среде, содержащей его необходимое количество для создания расчетной концентрации.
В результате исследований устанавливают значения предельных разведений, в которых обнаруживаются типичные для использованных пробиотиков микроорганизмы путем регистрации:
- визуальных признаков роста типичных колоний в использованной среде культивирования;
- роста типичных для тест-штаммов пробиотиков колоний при подтверждающем пересеве на плотные элективные среды;
- наличия клеток типичной морфологии при микроскопии мазков-препаратов из сред культивирования.
Подсчет количества клеток тест-штаммов производят путем умножения числа выросших колоний на соответствующее разведение. При отсутствии дифференцированного роста колоний учет результатов проводится по предельному разведению, в котором отмечается рост культуры и типичные микроскопические признаки. За окончательный результат принимается среднее арифметическое из 2 - 3-х параллельных посевов, которое выражается в lg КОЕ/мл.
Используются следующие критерии оценки воздействия изучаемых наноматериалов на микрофлору:
- при обнаружении одинакового количества КОЕ/г тест-штаммов пробиотиков в средах с испытуемым наноматериалом и в средах без него делается вывод об отсутствий влияния испытуемой концентрации наноматериала в модели in vitro;
- в случае достоверного превышения КОЕ/см тест-штаммов пробиотиков в средах с испытуемым веществом и в средах без него не менее чем на один логарифмический порядок делается вывод о стимулирующем действии данного наноматериала в модели in vitro;
- в случае достоверного уменьшения КОЕ/см тест-штаммов пробиотиков в средах с испытуемым веществом и в средах без него не менее чем на один логарифмический порядок делается вывод об ингибирующем действии данного наноматериала в модели in vitro.
При этом учитываются изменения морфологии клеток тест-культур по результатам микроскопической картины, динамика роста культур, а также наличие и массивность роста посторонней по отношению к тест-штаммам микрофлоры испытуемого образца.
9.10.2. Изучение выживаемости микроорганизмов-пробиотиков в присутствии наноматериалов на моделях in vitro, имитирующих условия пищеварения в организме ребенка и взрослого.
Для получения сведений о выживаемости микроорганизмов в желудочно-кишечном тракте детей и взрослых, используются модели in vitro, имитирующие физиолого-биохимические параметры, возникающие в процессе пищеварения в полости желудка и верхнего отдела тонкой кишки ребенка 1-го года жизни и взрослого человека. Для этого применяют специальные среды на основе цитратно-фосфатного буферного раствора (ЦФБР), исходящие из средних показателей кислотности желудочного и дуоденального сока с диапазоном рН 2,0 - 7,0, их ферментных компонентов, скорости физиологических сокращений, температуры.
В колбы асептически вносят по 10 см3 модельных сред со значениями рН 2,0 - 2,5 - 3,5 - 4,5 - 5,5 - 6,5 - 7,0 и дисперсию исследуемого наноматериала в соотношении 1:1. Затем в один ряд колб добавляли 0,5 мг/см3 пепсина; в другой - 25 мг/см3 ферментного препарата "Панзинорм" для моделирования пищеварительного процесса в желудке и 12-перстной кишке, соответственно. В третий ряд - ферменты не добавлялись (ЦФБР+наноматериал). В 4-й и 5-й ряды добавляли ферменты без наноматериала. В шестой ряд колб вносили только ЦФБР. Изучаемые микробы вводили в модельные среды в виде суспензии из суточных агаровых культур по ОСМ. Разведения культур готовили в 0,1% пептонной воде из расчета получить количества на уровне 3-го логарифмического порядка (103 КОЕ/мл), характерные для естественной контаминации, в т.ч. с учетом объема добавляемого пищевого продукта. Для контроля заражающей дозы из колб с последним значением рН (7,0) забирали 0,1 см3 суспензии и засевали на поверхность питательной среды. Колбы с содержимым инкубировали в течение 3 ч при постоянном встряхивании в термостатируемой водяной виброванне при 37°С с частотой колебаний 90/мин. По истечении инкубации из каждой колбы производили посев по 0,1 см3 суспензии на поверхность МПА в чашках Петри, равномерно распределяя шпателем (при необходимости готовили 10-кратные разведения инокулята). После термостатирования при 37°С в течение 18 - 20 ч подсчитывали количество выросших колоний общепринятым методом с дальнейшим пересчетом в КОЕ на 1 см3 модельной среды. Выживаемость микроорганизмов по сравнению с исходным количеством в исследуемых пробах выражали в процентах, рассчитывая по формуле:
% выживания = (Кк - Ко) /Кк×100%,
где Кк = число выросших колоний в контроле,
Ко = число клеток в опыте.
9.10.3. Определение содержания летучих короткоцепочечных жирных кислот в копрофильтратах.
Исследование проводится методом газохроматографического анализа в соответствии с Методическими рекомендациями N 96/130 "Диагностика анаэробной инфекции у детей методом хроматографии", Москва. 1997 (п. 4.3 "Анализ исследуемого биологического материала на содержание ЛЖК").
Кормление животных осуществляли в течение всего периода наблюдения (28 дней) стандартным рационом вивария или таким же рационом с добавлением исследуемого наноматериала или аналога наноматериала в традиционной форме в агравированных количествах. Фекалии животных собираются в стерильную посуду.
Отбирают 1 г свежесобранных фекалий и тщательно их гомогенизируют в 9 мл 2% перхлорной кислоты, центрифугируют 20 минут при 20 000 об/мин. Пробу переливают в патрон для перегонки с паром и добавляют 1 мл внутреннего стандарта. Патрон помещают в колбу с бидистиллированной водой, которую доводят до кипения. Конденсат в количестве 10 мл собирают в стерильную пробирку. В полученный раствор добавляют очищенную хлороформом NaCl, в соотношении 35 г соли на 100 г раствора.
После встряхивания пробирки с раствором проводят экстракцию эфиром (1 мл), после чего отбирают супернатант для определения жирных кислот.
Полученный эфирный экстракт в количестве 3 мкл вводят непосредственно в газожидкостный хроматограф.
Идентификацию ЛЖК осуществляют по относительному времени удерживания, для сравнения используют аналитические стандарты жирных кислот. Количественное содержание ЛЖК устанавливают при сравнении высот пиков на хроматограммах пробы и стандартного раствора с известной (5 мкмоль/л) концентрацией кислот.
В подготовленных копрофильтратах определяют следующие ЛЖК: уксусную, пропионовую, изомасляную, масляную, изовалериановую, валериановую, капроновую, а также продукты гниения белка - орто и пара-крезол.
Индивидуальные результаты определений летучих соединений, выраженные в ммоль/г фекалий, подвергают статистической обработке с помощью критерия Стьюдента и непараметрического рангового критерия Мана-Уитни. Различие между опытной и контрольной группами признаются достоверными на уровне значимости Р < 0,05. Расчеты проводят с помощью пакетов программ EXCEL и SPSS версии не старше 9.0.
9.10.4. Методы определения состава и свойств микрофлоры кишечника лабораторных животных.
После забоя животных, получавших опытный (содержащий наноматериал) и контрольные рационы, проводят отбор фекальных масс из содержимого их толстого кишечника в стерильную посуду. Общее количество собранных фекалий составляет не менее 1/2 бакпечатки. Образцы хранят не более 2 - 3 часов при 40°С.
Состояние микробиоценоза толстой кишки оценивают по результатам посева фекалий, разведенных фосфатно-тиогликолевым буфером, на дифференциально-диагностические и селективные среды. Количественный учет бифидобактерий проводят на среде Бактофок с последующей рН-метрией; лактобацилл - на среде МРС; энтеробактерий - на среде Эндо и цитратном агаре; бактерий рода протея - на средах, используемых для учета энтеробактерий. У части штаммов энтеробактерий проводят определение таксономической принадлежности на уровне вида с использованием системы мультимикротестов для биохимической идентификации энтеробактерий (Api 10S, Api20E, Api RapiD 20E) и применением классических методов исследования. Содержание стафилококков определяют на желточно-солевом агаре, с последующим определением плазмокоагулирующей активности; стрептококков - на кровяном агаре; энтерококков - на среде МИС; гемолитические свойства энтеробактерий, стафилококков, энтерококков - на кровяном агаре; количество сульфитредуцирующих клостридий - на модифицированной железо-сульфитной среде; дрожжеподобных грибов - на среде Сабуро, с дальнейшим определением характера филаментации и наличия хламидоспор на рисовом агаре. Содержание микроорганизмов выражают в lg КОЕ/г сырой массы фекалий.
Индивидуальные результаты определений содержания отдельных представителей микрофлоры, выраженные в ммоль/г фекалий, подвергают статистической обработке с помощью критерия Стьюдента и непараметрического рангового критерия Мана-Уитни. Различие между опытной и контрольной группами признаются достоверными на уровне значимости Р < 0,05. Расчеты проводят с помощью пакетов программ EXCEL и SPSS версии не старше 9.0.
Список литературы
1. Трахтенберг И.М., Сова Р.Е., Шефтель В.О., Оникиенко Ф.А. Показатели нормы у лабораторных животных в токсикологическом эксперименте. - М.: Медицина, 1978.
2. Лабораторные методы исследования в клинике: Справочник/Под редакцией Меньшикова В.В. - М.: Медицина, 1987. - С. 174 - 175.
3. Лабораторные методы исследования в клинике: Справочник/Под редакцией Меньшикова В.В. - М.: Медицина, 1987. - 176 с.
4. Лабораторные методы исследования в клинике: Справочник/Под редакцией Меньшикова В.В. - М.: Медицина, 1987. - С. 177 - 179.
5. Лабораторные методы исследования в клинике: Справочник/Под редакцией Меньшикова В.В. - М.: Медицина, 1987. - С. 230 - 234.
6. Лабораторные методы исследования в клинике: Справочник/Под редакцией Меньшикова В.В. - М.: Медицина, 1987. - С. 216.
7. Биохимические методы исследования в клинике/Под редакцией Покровского А.А. - М.: Медицина, 1969. - 103 с.
8. Лабораторные методы исследования в клинике: Справочник/Под редакцией Меньшикова В.В. - М.: Медицина, 1987. - С. 220 - 221.
9. Биохимические методы исследования в клинике/Под редакцией Покровского А.А. - М.: Медицина, 1969. - С. 289.
10. Биохимические методы исследования в клинике/Под редакцией Покровского А.А. - М.: Медицина, 1969. - С. 300.
11. Лабораторные методы исследования в клинике: Справочник/Под редакцией Меньшикова В.В. - М.: Медицина, 1987. - С. 242 - 243.
12. Биохимические методы исследования в клинике/Под редакцией Покровского А.Д. - М.: Медицина, 1969. - С. 294.
13. Лабораторные методы исследования в клинике: Справочник/Под редакцией Меньшикова В.В. - М.: Медицина, 1987. - С. 246 - 247.
14. Методические указания по атомно-абсорбционным методам определения токсичных элементов в пищевых продуктах и пищевом сырье.: ГКСЭН РФ N 02.19/47-11.
15. Лабораторные методы исследования в клинике: Справочник/Под редакцией Меньшикова В.В. - М.: Медицина, 1987. - С. 186 - 190.
16. Биохимические методы исследования в клинике/Под редакцией Покровского А.А. - М.: Медицина, 1969. - С. 111 - 114.
17. Лабораторные методы исследования в клинике: Справочник/Под редакцией Меньшикова В.В. - М.: Медицина, 1987. - С. 205 - 208.
18. Биохимические методы исследования в клинике/Под редакцией Покровского А.А. - М.: Медицина, 1969. - С. 158 - 162.
19. Тиц Н. Энциклопедия клинических лабораторных тестов. - М.: Лабинформ, 1997.
20. Мальцев Г.Ю., Орлова Л.А.//Вопросы мед. химии, 1994. - N .1 - С. 59 - 61.
21. Mille G.J.//Biol.Chem., 1959. - V. 244. - P. 502 - 506.
22. Osino N.//Chance B.Arch. Biochem., 1973. - V. 154. - P. 117.
23. Мальцев Г.Ю. Васильев А.В.// Вопросы мед. химии, 1994. - N .2. - С. 56 - 58.
24. Niashikimi М., Rao N.A. Jagi К. //Biochem. Biophys. Res. Commun, 1972. - V. 46. - P. 849 - 854.
25. Лабораторные методы исследования в клинике: Справочник/Под редакцией Меньшикова В.В. - М.: Медицина, 1987. - С. 168.
26. Иргашев Ш.Б., Юлдашев Н.М., Гурнев С.Б., Хадиметова Ш.А., Эльмуратова М.Т. Процессы гидроксилирования и интенсивность ПОЛ в микросомах печени при экспериментальном инфаркте миокарда//. Патологическая физиология и экспериментальная терапия, 1993. - N 3. - С. 19 - 20.
27. Ernster L., Nordenbrandt K.//Meth. Enzymology, 1967, V. 10. - P. 575.
28. Гаврилов В.Б., Мишкорудная М.И.//Лаб. дело, 1983. - V. 3 - Р. 33 - 35.
29. Placer Z.//Nahrung, 1968. - V. 12. - Р. 679.
30. Tilbotsen J.A., Sauberlich H.S.//J.Nutr., 1971. - V. 101. - P. 1459.
31. Биохимические методы исследования в клинике/Под редакцией Покровского А.А. - М.: Медицина, 1969. - С. 131 - 138.
32. Лабораторные методы исследования в клинике: Справочник/Под редакцией Меньшикова В.В. - М.: Медицина, 1987. - С. 191 - 192.
33. Лабораторные методы исследования в клинике: Справочник/Под редакцией Меньшикова В.В. - М.: Медицина, 1987. - С. 47 - 48.
34. Лабораторные методы исследования в клинике: Справочник/Под редакцией Меньшикова В.В. - М.: Медицина, 1987. - С. 49 - 50.
35. Лабораторные методы исследования в клинике: Справочник/Под редакцией Меньшикова В.В. - М.: Медицина, 1987. - С. 51.
36. Omura Т., Sato R.// Biol Chem, 1964. - N 239, - P. 2370 - 2377.
37. Карузина И.И., Арчаков А.И. Современные методы в биохимии. - М.: Медицина, 1977. - С. 49 - 62.
38. Fuov F., Azyrv U. Katnattaki Т. et al//J.Pharmac, 1979. - N 29. - P. 191 - 201.
39. Dehnen W.et al //Anal.Bioch.1977. - N 53, - P. 373 - 383.
40. Lake B.Y.//Biochem. Toxicol, 1987. - P. 207 - 209.
41. Lake В.Y.//Biochem. Toxicol, 1987. - P. 209 - 211.
42. Лингл Д. Лизосомы. Методы исследования. - перс англ. - М. - 1980.
43. Кравченко Л.В., Соболев В.С.// Бюллетень эксперим. биологии и медицины, 1988. - N 8. - С. 179 - 181.
44. Book К.W. et al//Biochem. Pharmac - 1980. - N 29. - P. 495 - 500.
45. Лабораторные методы исследования в клинике: Справочник/Под редакцией Меньшикова В.В. - М.: Медицина, 1987. - С. 107 - 108.
46. Лабораторные методы исследования в клинике: Справочник/Под редакцией Меньшикова В.В. - М.: Медицина, 1987. - С. 110.
47. Лабораторные методы исследования в клинике: Справочник/Под редакцией Меньшикова В.В. - М.: Медицина, 1987. - С. 115 - 124.
48. Роскин Г.И., Левинсон Л.Б. "Микроскопическая техника". М.: Сов. наука, 1957.
49. Р. Лилли. Патогистологическая техника и практическая гистохимия. - М.: Мир, 1969.
50. Автандидов Г. Г. Морфометрия в патологии. - М.: Медицина, 1973.
51. Методические указания по изучению эмбриотоксического действия фармакологических веществ и влияния их на репродуктивную функцию, - М.: Фармакологический Комитет, 1982.
52. Саноцкий И.В., Фоменко В.И. Отдаленные последствия влияния химических соединений на организм. - М.: Медицина, 1979. - 231 С.
53. Малашенко А.М., Суркова Н.И..// Генетика, 1973. - Т. 9 - N 4, С. 147.
54. Ames В.N, Whitfield H.Y. - //Hlth. perspectives, 1973. - V. 6. - Р. 115.
55. Ames B.N, Zee F., Durston W.//Proc. Nat. Acad. Sci. USA, 1973. - V. 70. - P. 782.
56. Лабораторные методы исследования в клинике: Справочник/Под редакцией Меньшикова В.В. - М.: Медицина, 1987. - С. 179 - 180.
57. Qakber S.//Am. J. Anat., 1956. - V. 99. - P. 507.
58. Медведев Н.Н. Практическая генетика. М.: Наука, 1968. - 294 С.
59. Белецкий Г.А., Шарупич Е.Г., Хованская Е.М.: Методические рекомендации по применению соматического мутагенеза у Dr. melanogaster в качестве тест-системы для ускоренного определения канцерогенов. - М.: МЗ СССР, 1982.
60. Ames B.N., Durston W.E. Ymasaki E, Lee E.D. Carcinogens are mutagens: a simple test system combining" liver homogenates for activation and Bacteria for detection-// Proc. Nat. Acad. Sci. USA, 1973. - V. 70. - P. 2281.
61. Фонштейн Л.М., Абилев С.К., Бобринев Е.Ф. и др. Методы первичного выявления генетической активности загрязнителей среды с помощью бактериальных тест-систем: Методические указания. - М., 1985. - 34 С.
62. Dona V. Papagni М V. Tarenghy V. et.al //J.Ital. Chim.Clin, 1987. - V. 12. - P. 205 - 214.
63. Применение метода щелочного гель-электрофореза изолированных клеток для оценки генотоксических свойств природных и синтетических соединений" Методические рекомендации, утвержденные РАМН и РАСХН, Москва, 2006 г.
64. Keller S., Schieter S., Vc. Kednee F//J. Immunology Meth, 1981. - V. 51. - P. 287 - 291.
65. Логинский В. E. //Лабораторное дело, 1976. - N 3. - С. 182.
66. Фримель Г. Иммунологические методы. - М.: Медицина, 1987.
67. Чередеев А. Н. //Общие вопросы патологии, 1976. - Т. 4. - С. 130.
68. Бухарин О. В., Васильев Н. В. "Лизоцим и его роль в биологии и медицине". Томск, 1974. - С. 37.
69. Лабораторная иммунология. Лабораторные методы исследования в неинфекционной иммунологии. - М., 1967. - 356 С.
70. Иммуномодулирование: Сборник трудов. - М., 1987. - С. 3 - 25.
71. Preston N. W.// Path.Bact., 1959. - V. 78. - N 1. - P. 217 - 224.
|
|