|
||||||||||||||||||||||||
Государственная система санитарно-эпидемиологического нормирования Российской Федерации
1.1. ОБЩИЕ ВОПРОСЫ. ГИГИЕНА, ТОКСИКОЛОГИЯ, САНИТАРИЯ
Биотестирование продукции из полимерных и других материалов
Методические указания
МУ 1.1.037-95
Госкомсанэпиднадзор России
Москва
1996
1. Разработаны Московским городским центром Государственного комитета санитарно-эпидемиологического надзора России (Завьялов Н. В.), Всероссийским научно-исследовательским и испытательным институтом медицинской техники Министерства здравоохранения и медицинской промышленности России (Ланио В. Г., Еськов А. Н.). Акционерным обществом «БМК-ИНВЕСТ» (Каюмов Р. И.).
2. Утверждены и введены в действие Председателем Госкомсанэпиднадзора России - Главным государственным санитарным врачом Российской Федерации 20 декабря 1995 г.
СОДЕРЖАНИЕ
|
3. Средства измерения, оборудование и реактивы.. 2 4. Отбор образцов и приготовление вытяжек. 2 |
УТВЕРЖДАЮ
Председатель Госкомсанэпиднадзора
России - Главный государственный
санитарный врач Российской Федерации
Е. Н. Беляев
20 декабря 1995 г.
МУ 1.1.037-95
Дата введения:
с момента утверждения
1.1. ОБЩИЕ ВОПРОСЫ. ГИГИЕНА, ТОКСИКОЛОГИЯ, САНИТАРИЯ
Биотестирование продукции из полимерных и других материалов
Biotesting of products made of polymer and other materials
Методические указания
1. Область применения
Методические указания предназначены для токсикологических исследований и испытаний полимерных материалом, резин, химических веществ и различных изделий из них: изделия детского ассортимента (игрушки, игры, и т.п.); изделия, контактирующие с пищевыми продуктами (посуда, упаковка и т.п.); строительные и отделочные материалы и т.д. Методика может быть применена в качестве самостоятельного экспресс-метода или в сочетании с другими токсиколого-гигиеническими методами для оценки безопасности вновь разрабатываемых изделий и продуктов, а также для скринингового контроля отдельных партий серийно выпускаемой и сертифицированной продукции.
Методические указания содержат описание экспресс-метода и определяют порядок проведения токсикологических испытаний изделий с целью обеспечения безопасности их применения для потребителя.
2. Сущность методики
Сущность методики состоит в исследовании острой токсичности вытяжки из испытываемых изделий с применением клеточного тест-объекта. В качестве тест-объекта используется сперма крупного рогатого скота, замороженная в парах жидкого азота. Гранулы замороженной бычьей спермы получают на станциях искусственного осеменения и хранят в сосудах Дьюара, наполненных жидким азотом. В основе метода лежит исследование изменений зависимости двигательной активности сперматозоидов от времени под воздействием химических соединений, содержащихся в вытяжке из исследуемых образцов. Показатель подвижности, m=f(t) определен как:
![]() где
где
d - постоянный коэффициент,
Cn - концентрация подвижных клеток,
![]() - средний
модуль скорости клеток.
- средний
модуль скорости клеток.
Оценка показателя подвижности осуществляется путем подсчета изменений интенсивности светового потока при движении сперматозоидов через оптический зонд.
Данный вид испытаний позволяет с минимальными затратами времени и средств сделать выводы о токсичности вытяжки.
3. Средства измерения, оборудование и реактивы
3.1. Стенд дли испытаний вытяжек на токсичность (приложение 1, рекомендуемое).
3.2. Комплект кювет (приложение 1, рекомендуемое).
3.3. Химическое оборудование:
- пробирки с притертыми пробками объемом 3-5 мл - 10 шт., ГОСТ 1770-74,
- дозаторы пипеточные на объемы 0,5 мл, 0,2 мл и 0,1 мл, 2T2.993.053 ТУ,
- мерные колбы с притертыми пробками объемом 50 мл - 2 шт., ГОСТ 1770-74.
3.4. Весы аналитические с погрешностью взвешивания не более 1 мг, ГОСТ 24104-88.
3.5. Пинцет анатомический длиной 250 мм.
3.6. Сосуд Дьюара типа СДС, объемом не менее 25 л и диаметром горла не менее 50 мм - 2 шт.
3.7. Глюкоза ч., ГОСТ 6038-74.
3.8. Цитрат натрия трехзамещенный ч., ГОСТ 22280-76.
3.9. Сперма быка, замороженная в жидком азоте, ГОСТ 26030-83.
4. Отбор образцов и приготовление вытяжек
Для проведения испытаний производится отбор образцов из партии изделий в количестве, обеспечивающем получение пробы не менее 30 г, но не менее 20 штук каждого наименования.
Испытуемые изделия дробятся на куски максимальным сечением, не превышающим 20´20 мм. Отбирается навеска 30 г. При этом в пробе должны быть представлены кусочки всех материалов, используемых в изделии. Полученные образцы помещают в термостойкую колбу со шлифом емкостью 250 мл, заливают 100 мл дистиллированной воды и помещают на 24 часа в термостат с температурой (40±2) °С. При испытании посуды из полимерных материалов образцы, помещенные в термостойкую колбу, заливаются 100 мл кипящей дистиллированной воды. По достижении температуры вытяжки 40 °С колбу помещают в термостат и термостатируют до 24 часов при температуре (40±2) °С. Допускается проводить испытания посуды путем заполнения ее кипящей дистиллированной водой до номинального объема. При снижении температуры до 40 °С посуда помещается в полиэтиленовый мешок и закладывается в термостат в условиях, указанных выше.
5. Проведение испытаний
5.1. Все растворы в течение эксперимента должны постоянно находиться при постоянной температуре (40±1,5) °С. Поддержание температуры осуществляется автоматически устройством термостатирования.
5.2. Для определения индекса токсичности опытного раствора необходимо сравнить его с контрольной (модельной) средой. В качестве контрольного раствора выбрана глюкозо-цитратная среда (глюкоза - 4 г, цитрат натрия - 1 г, дистиллированная вода - 100 мл). Контрольная среда одновременно является разбавителем для оттаивания замороженной спермы. Опытным раствором является вытяжка из изделия, доведенная до изотонии сухими реактивами глюкозы и цитрата натрия (глюкоза - 4 г, цитрат натрия - 1 г, испытуемый раствор -100 мл). Контрольный и опытный растворы по 0,4 мл помещают в пробирки с притертыми пробками и ставят в водяную баню при температуре (40±1,5) °С. Контрольный и опытный растворы приготавливают заранее, за час до начала эксперимента.
5.3. Оттаивают замороженную сперму. Для этого дозируют в пробирки разбавитель согласно паспорту на сперму быка и ставят их в водный термостат при температуре (40±1,5) °С. Охлажденным до температуры жидкого азота анатомическим пинцетом извлекают из сосуда Дьюара гранулу спермы и быстро опускают в нагретый раствор.
Не допускается оттаивать несколько гранул в одной пробирке!
Сразу после размораживания содержимое пробирок с целью приготовления маточного раствора спермы сливают в пробирку и тщательно перемешивают.
5.4. Приготавливают рабочие образцы. В каждую пробирку контрольной и опытной серий помещают по 0,1 мл маточного раствора спермы.
5.5. Подготавливают пробы к исследованию. Каждый рабочий образец переносят в кювету. Кювету герметизируют, устанавливают в кюветодержатель и помещают в стенд для испытания вытяжек.
5.6. Проводят накопление экспериментальных данных. Нажатием кнопки «ПУСК» на стенде для испытаний включают процесс накопления данных. При достижении нулевых значений показателя подвижности во всех кюветах отжатием кнопки "ПУСК» на стенде для испытаний производят остановку процесса накопления данных.
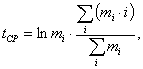 где
где
mi - i-e значение показателя подвижности,
i - текущий номер оценки показателя подвижности.
Для контрольной и опытной выборок образцов вычисляют среднее арифметическое значение и среднеквадратичное отклонение, по которым в свою очередь вычисляют для каждой выборки коэффициент вариации С,
![]() где
где
d - среднеквадратичное отклонение,
![]() - среднее
арифметическое значение.
- среднее
арифметическое значение.
В случае получения значения коэффициента вариации более 15 % хотя бы для одной из выборок, эксперимент повторяют, начиная с 5.1. Если значения коэффициентов вариации для каждой из выборок меньше или равны 15 %, то результаты считают статистически значимыми. Затем вычисляют величину индекса токсичности It,
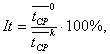 где
где
![]() и
и ![]() - средние
арифметические значения средневзвешенного времени подвижности соответственно
для опытной и контрольной выборок образцов.
- средние
арифметические значения средневзвешенного времени подвижности соответственно
для опытной и контрольной выборок образцов.
6. Оценка результатов испытаний
Оценка результатов испытаний осуществляется путем сравнения полученных значений индексов токсичности для исследованных образцов и допустимого интервала индекса токсичности. Испытуемая партия изделий считается нетоксичной, если индекс токсичности соответствует 70-120 %. Во всех остальных случаях результаты свидетельствуют о возможной токсичности исследованных образцов и требуют проведения дополнительных исследований с применением количественных методов, утвержденных в установленном порядке.
Приложение 1
(Рекомендуемое)
Стенд для испытаний вытяжек на токсичность
1. Назначение
1.1. Стенд для испытания вытяжек на токсичность (далее стенд) предназначен для исследования острой токсичности вытяжек из испытываемых изделий с применением клеточного тест-объекта.
2. Краткое техническое описание стенда
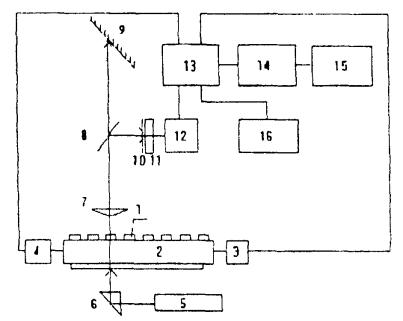
2.1. Принципиальная схема стенда должна соответствовать приведенной на рис. 1.
Стенд содержит кюветы (капилляры) 1, каретку 2, привод 3, блок термостатирования 4, лазер 5, светоделительную пластину 6, микрообъектив 7, светоделительную пластину 8, экран 9, маску 10, фотодиод 11, усилитель 12, контроллер 13, компьютер 14, принтер 15, блок подготовки проб и рабочих образцов 16.
Конструктивное исполнение стенда обеспечивает одновременно оценку подвижности суспензии рабочего образца и визуальное наблюдение за клетками суспензии.
2.2. Проведение испытаний.
Включают стенд. С помощью компьютера 14 задают контроллеру 13 необходимые значения температуры каретки и блока пробоподготовки, время одного анализа, количество используемых в данном эксперименте капилляров. После получения на дисплее компьютера информации о достижении заданных значений температур проводят приготовление рабочих образцов в соответствии с п. 5.7. Переносят рабочие образцы в капилляры и герметизируют. Помещают кюветы с рабочими образцами 1 на каретку 2 и устанавливают в привод 3. Проводят идентификацию капилляров и запускают процесс накопления экспериментальных данных. При достижении нулевых значений показателя подвижности во всех капиллярах останавливают процесс накопления экспериментальных данных и проводят их математическую обработку по алгоритмам, приведенным в п. 5.7. Результаты расчетов распечатывают на принтере 15 и записывают в базу данных. При необходимости происходящее в капиллярах с рабочими образцами наблюдают визуально на экране 9. Поддержание необходимой температуры каретки и на блоке пробоподготовки, а также перемещение каретки осуществляется автоматически контроллером 13 и компьютером 14.
Стенд для испытаний вытяжек на токсичность.
Рис. 1. 1 - капилляр, 2 - каретка, 3 - привод, 4 - блок термостатирования, 5 - лазер, 6 - светоделительная пластина, 7 - микрообъектив, 8 - светоделителъная пластина, 9 - экран, 10 - маска, 11 - фотодиод, 12 - усилитель, 13 - контроллер, 14 - компьютер, 15 - принтер, 16 - блок подготовки проб и рабочих образцов.
3. Технические характеристики стенда для испытаний
3.1. Длина волны лазерного излучения - 0,63 мкм.
3.2. Мощность лазерного излучения не менее 1 мВт.
3.3. Время одного анализа от 10 до 300 с с шагом 10 с.
3.4. Время перемещения капилляра с образцом не более 2 с.
3.5. Время обратного хода каретки не более 15 с.
3.6. Изменение температуры проб и рабочих образцов в диапазоне (35-45) °С с шагом 1 °С и с отклонением температуры от установленного значения ±0,5 °С.
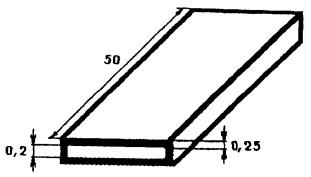
3.7. Основные размеры кюветы должны соответствовать приведенным на рис. 2.
Кювета (капилляр)
Рис. 2.
|
|